Bài 11.4, 11.5, 11.6, 11.7, 11.8 trang 16 SBT Hóa học 8
Bài 11.4, 11.5, 11.6, 11.7, 11.8 trang 16 SBT Hóa học 8
Bài 11.4 trang 16 sách bài tập Hóa 8: Lập công thức hóa học và tính phân tử khối của các hợp chất có phân tử gồm Ag(I), Mg, Zn và Fe(III) lần lượt liên kết với:
a) Nhóm (NO3).
b) Nhóm (PO4).
Lời giải:
a) Nhóm (NO3):
* Ag và (NO3): Ta có: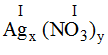
Theo quy tắc: x.I = y.I → 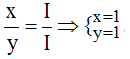
Vậy công thức hóa học của Agx(NO3)y là AgNO3.
Phân tử khối = 108 + 14 + 16.3 = 170 đvC
* Mg và (NO3): Ta có: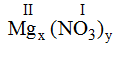
Theo quy tắc: x.II = I.y → 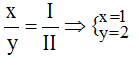
Vậy công thức hóa học của Mgx(NO3)y là Mg(NO3)2.
Phân tử khối của Mg(NO3)2 = 24 + 2.(14 + 16.3) = 148 đvC
* Zn và (NO3): Ta có: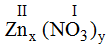
Theo quy tắc: x.II = I.y → 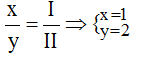
Vậy công thức hóa học của Znx(NO3)y là : Zn(NO3)2.
Phân tử khối = 65 + 2.(14+ 16.3) = 189 đvC
* Fe (III) và (NO3): Ta có: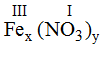
Theo quy tắc: x.III = y.I → 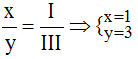
Vậy công thức hóa học của Fex(NO3)y là Fe(NO3)3.
Phân tử khối = 56 + 3.(14 + 16.3) = 242 đvC
b) Nhóm (PO4):
* Ag và (PO4): Ta có: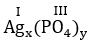
Theo quy tắc: x.I = III.y → 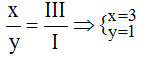
Vậy công thức hóa học của Agx(PO4)y là Ag3PO4
Phân tử khối = 108.3 + 31 + 16.4 = 419 đvC
* Mg và (PO4): Ta có: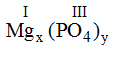
Theo quy tắc: x.I = III.y → 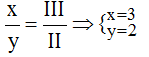
Vậy công thức hóa học là Mg3(PO4)2
Phân tử khối = 24.3 + 2.(31 + 16.4) = 385 đvC
* Fe(III) và (PO4): Ta có: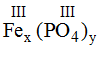
Theo quy tắc: x.III = y.III → 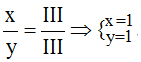
Vậy công thức hóa học là FePO4.
Phân tử khối của FePO4 = 56 + 31 + 16.4 = 151 đvC
Bài 11.5 trang 16 sách bài tập Hóa 8: Công thức hóa học của một số hợp chất của nhôm viết như sau: AlCl4; AlNO3; Al2O3 ; AlS; Al3(SO4)2; Al(OH)2; Al2(PO4)3.
Biết rằng trong các số này chỉ một công thức đúng và S có hóa trị II hãy sửa lại những công thức sai.
Lời giải:
- Công thức hóa học đúng là Al2O3.
- Các công thức còn lại là sai. Sửa lại cho đúng:
AlCl3; Al(NO3)3; Al2S3; Al2(SO4)3; Al(OH)3; AlPO4.
Bài 11.6 trang 16 sách bài tập Hóa 8: Cho biết tổng số các hạt proton, nơtron, electron tạo nên một nguyên tử một nguyên tố bằng 49, trong đó số hạt không mang điện là 17.
a) Tính số p và số e có trong nguyên tử.
b) Viết tên, kí hiệu hóa học và nguyên tử khối của nguyên tố.
c) Vẽ sơ đồ đơn giản của nguyên tử.
d) Số lớp electron và số electron lớp ngoài cùng có gì giống và khác so với nguyên tử O?
Lời giải:
Trong 1 nguyên tử có số p = số e và nơtron là hạt không mang điện.
Theo đề bài, ta có: n = 17
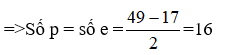
Vậy số p và số e bằng 16.
b) Nguyên tố này là lưu huỳnh, kí hiệu S, nguyên tử khối là 32 đvC.
c) Sơ đồ đơn giản của nguyên tử S:
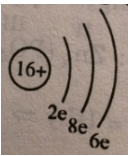
d) Nguyên tử lưu huỳnh có 3 lớp electron và 6 eletron lớp ngoài cùng
+ Khác: với nguyên tử O chỉ có 2 lớp electron.
+ Giống: với nguyên tử O là có cùng 6e ở lớp ngoài cùng.
Bài 11.7 trang 16 sách bài tập Hóa 8: Một số hợp chất của nguyên tố T hóa trị III vơi nguyên tố oxi, trong đó T chiếm 53% về khối lượng.
a) Xác định nguyên tử khối và tên nguyên tố T.
b) Viết công thức hóa học và tính phân tử khối của hợp chất.
Lời giải:
a) Gọi công thức của hợp chất là T2O3 và a là nguyên tử khối của T.
Theo đề bài, ta có tỉ lệ phần trăm khối lượng của T:
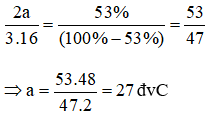
Nguyên tố T là nhôm.
b) Công thức hóa học của hợp chất là Al2O3.
Phân tử khối: 27.2 + 16.3 = 102 đvC.
Bài 11.8 trang 16 sách bài tập Hóa 8: Hợp chất A tạo bởi hidro và nhóm nguyên tử (XOx) hóa trị III.
Biết rằng phân tử A nặng bằng phân tử H2SO4 và nguyên tố oxi chiếm 65,31% về khối lượng a.
a) Xác định chỉ số y và nguyên tử khối của nguyên tố X.
b) Viết tên, kí hiệu hóa học của X và công thức hóa học của A.
Lời giải:
a) Gọi công thức của A là H3XOy (vì nhóm XOy hóa trị III nên theo quy tắc hóa trị ta xác định được phân tử có 3 nguyên tử H)
Phân tử khối của H2SO4: 2 + 32 + 16.4 = 98 (đvC)
Vì A nặng bằng phân tử H2SO4 nên PTK của A là 98 đvC
Theo đề bài, ta có khối lượng của nguyên tố oxi trong hợp chất là:
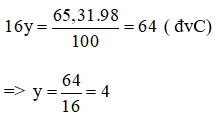
→ có 4 nguyên tử oxi trong hợp chất A.
Vậy nguyên tử khối của X là: 98 – (3 + 64) = 31 (đvC)
b) Tên nguyên tố là photpho, kí hiệu hóa học là P.
Công thức hóa học của A là H3PO4.

