Bài 27.1, 27.2, 27.3, 27.4 trang 33 SBT Hóa học 9
Bài 27.1, 27.2, 27.3, 27.4 trang 33 SBT Hóa học 9
Bài 27.1 trang 33 Sách bài tập Hóa học 9: Người ta đã căn cứ vào tính chất vật lí và tính chất hoá học của than để sử dụng than trong thực tế đời sống như thế nào ? Cho thí dụ.
Lời giải:
- Dựa vào khả năng hấp phụ của than để hấp phụ các chất độc (dùng trong mặt nạ phòng độc), loại chất bẩn trong lọc đường, lọc dầu thực vật, làm xúc tác cho phản ứng giữa các chất khí.
- Phản ứng của than với oxi toả nhiều nhiệt cho nên từ lâu than được dùng làm chất đốt, làm nguyên liệu trong quá trình luyện quặng thành gang.
- Cacbon dùng làm chất khử : 3C + Fe2O3 → 3CO + 2Fe
Nhiệt độ càng cao, tính khử của cacbon càng mạnh. Người ta dùng cacbon để điều chế một số kim loại từ oxit của chúng.
Bài 27.2 trang 33 Sách bài tập Hóa học 9: Viết phương trình hoá học của các phản ứng sau và cho biết tính chất hoá học của cacbon (là chất oxi hoá hay chất khử)
(1) C + CO2 to CO (2) C + Fe2O3 to Fe + CO (3) C + CaO to CaC2 + CO (4) C + PbO to Pb + CO2 (5) C + CuO to Cu + CO2
Lời giải:
(1) C + CO2 to 2CO
(2) 3C + Fe2O3 to 2Fe + 3CO
(3) 3C + CaO to CaC2 + CO
(4) C + 2PbO to 2Pb + CO2
(5) C + 2CuO to 2Cu + CO2
Bài 27.3 trang 33 Sách bài tập Hóa học 9: Trong quá trình luyện quặng sắt thành gang, người ta dùng CO làm chất khử. Hãy tính thể tích khí CO (đktc) có thể thu được từ 1 tấn than chứa 90% cacbon, nếu hiệu suất của cả quá trình phản ứng là 85%.
Lời giải:
Khối lượng cacbon trong 1 tấn than: 1000x90/100 = 900 tấn
2C + O2 → 2CO
2x12kg 2x22,4m3
900kg x m3
x = 900 x 2 x 22,4/(2x12) = 1680 (m3)
Thực tế, thể tích khí CO thu được là: 1680 x 85/100 = 1428 (m3)
Bài 27.4 trang 33 Sách bài tập Hóa học 9: Viết phương trình hóa học biểu diễn những chuyển đổi hóa học sau:
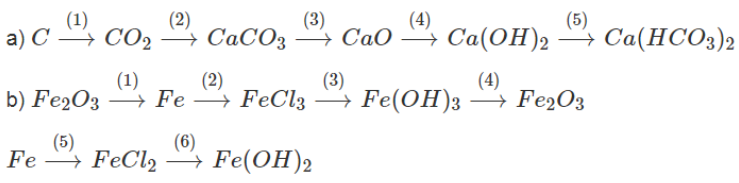
Lời giải:
Phương trình háo học :
a)
(1) C + O2 to CO2
(2) CO2 + Ca(OH)2 → CaCO3 + H2O
(3) CaCO3 → CaO + CO2
(4) CaO + H2O → Ca(OH)2
(5) Ca(OH)2 + 2CO2 → Ca(HCO3)2
b)
(1) Fe2O3 + 3H2 → 2Fe + 3H2O
(2) 2Fe + 3Cl2 → 2FeCl3
(3) FeCl3 + 3NaOH → 3NaCl + Fe(OH)3
(4) 2Fe(OH)3 → Fe2O3 + 3H2O
(5) Fe + HCl → FeCl2 + H2
(6) FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl

