Bài 19.12, 19.13, 19.14 trang 25 SBT Hóa học 9
Bài 19.12, 19.13, 19.14 trang 25 SBT Hóa học 9
Bài 19.12 trang 25 Sách bài tập Hóa học 9: Hoàn thành sơ đồ phản ứng sau:
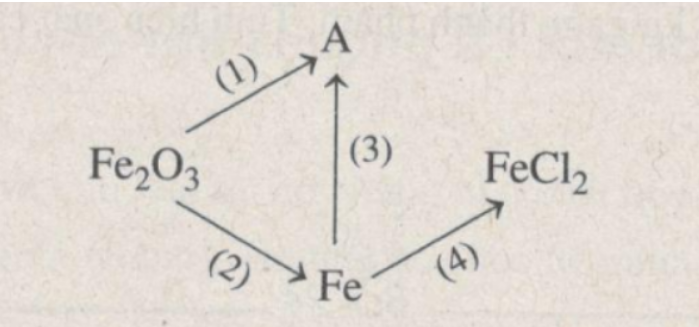
Lời giải:
(1) Fe2O3 + 6HCl → 2FeCl3 + 3H2O
(2) Fe2O3 + H2 → 2Fe + 3H2O
(3) 2Fe + 3Cl2 → 2FeCl3
(4) Fe + 2HCl → FeCl2 + H2
Bài 19.13 trang 25 Sách bài tập Hóa học 9: Cho m gam hỗn hợp Fe và Zn tác dụng vừa hết với 1 lít dung dịch HCl 2,5M (D = 1,19 g/ml) thấy thoát ra một chất khí và thu được 1200 gam dung dịch. Xác định giá trị của m.
Lời giải:
mdd HCl = 1000.1,19 = 1190 g
Áp dụng định luật bảo toàn khối lượng ta có:
mhh + 1190 = 1200 + mH2
Phương trình hóa học của phản ứng:
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
Qua phương trình hóa học trên, ta nhận thấy:
nH2 = 1/2nHCl; nH2 = 2,5/2 = 1,25 mol
mhh = 1200 - 1190 +(1,25x2) = 12,5g
Bài 19.14 trang 25 Sách bài tập Hóa học 9: Cho hai mẩu Fe có khối lượng bằng nhau. Cho một mẩu hoà tan hoàn toàn trong dung dịch HCl tạo 19,05 gam muối. Cho mẩu còn lại tan hoàn toàn trong dung dịch H2SO4 loãng thì khối lượng muối sunfat tạo ra là bao nhiêu ?
Lời giải:
Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2
Fe + H2SO4 → FeSO4 + H2
Qua các phương trình hóa học trên và dữ liệu đề bài, ta có:
nFeCl2 = 19,05/127 = 0,15 mol = nFe
mFeSO4 = 0,15 x 152 = 22,8g

