Giải Hóa học 11 trang 10 Kết nối tri thức
Haylamdo biên soạn và sưu tầm với Giải Hóa học 11 trang 10 trong Bài 1: Khái niệm về cân bằng hoá học Hóa học lớp 11 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 11 trang 10.
Giải Hóa học 11 trang 10 Kết nối tri thức
Câu hỏi 6 trang 10 Hóa học 11:
Viết biểu thức hằng số cân bằng cho các phản ứng sau:
a) Phản ứng tổng hợp ammonia: N2(g) + 3H2(g) ⇌ 2NH3(g)
b) Phản ứng nung vôi: CaCO3(s) ⇌ CaO(s) + CO2(g)
Lời giải:
Biểu thức hằng số cân bằng của các phản ứng:
a) KC = b) KC = [CO2] Chú ý: Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng. Câu hỏi 7 trang 10 Hóa học 11: Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g) Ở toC, nồng độ các chất ở trạng thái cân bằng là: [N2] = 0,45 M; [H2] = 0,14 M; [NH3] = 0,62 M. Tính hằng số cân bằng KC của phản ứng trên tại t oC.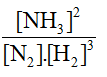
Lời giải:
Hằng số cân bằng KC của phản ứng tại t oC là:
KC = Thí nghiệm 1 trang 10 Hóa học 11: Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng: 2NO2(g) ⇌ N2O4(g) (màu nâu đỏ) (không màu) Chuẩn bị: 3 ống nghiệm chứa khí NO2 nút kín có màu giống nhau, cốc nước đá, cốc nước nóng. Tiến hành: - Ống nghiệm (1) để so sánh. - Ngâm ống nghiệm (2) vào cốc nước đá trong khoảng 1 – 2 phút. - Ngâm ống nghiệm (3) vào cốc nước nóng trong khoảng 1 – 2 phút. Lưu ý: NO2 là một khí độc, chú ý nút kín ống nghiệm. Quan sát sự thay đổi màu sắc của khí trong các ống nghiệm và hoàn thành vào vở theo mẫu bảng sau:
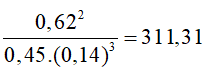
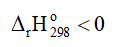
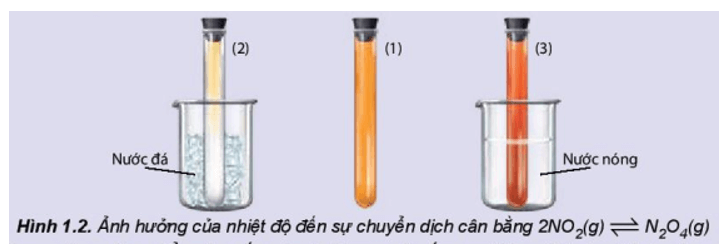

Lời giải:
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
|
Tăng nhiệt độ |
Màu khí trong ống nghiệm đậm dần lên |
Nghịch |
Thu nhiệt |
|
Giảm nhiệt độ |
Màu khí trong ống nghiệm nhạt dần đi |
Thuận |
Toả nhiệt |
Lời giải Hóa 11 Bài 1: Khái niệm về cân bằng hoá học Kết nối tri thức hay khác:

