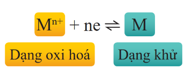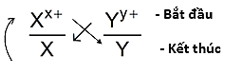Lý thuyết Hóa học 12 Bài 10: Thế điện cực chuẩn của kim loại - Cánh diều
Haylamdo biên soạn tóm tắt lý thuyết Hóa 12 Bài 10: Thế điện cực chuẩn của kim loại sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa 12 Bài 10: Thế điện cực chuẩn của kim loại - Cánh diều
I. CẶP OXI HOÁ - KHỬ CỦA KIM LOẠI
- Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá - khử của kim loại đó. Cặp oxi hoá - khử được kí hiệu chung là oxh/kh.
- Ví dụ: Phản ứng Ag+(aq) + Fe2+ (aq) → Ag(s) + Fe3+( aq) có liên quan đến hai cặp oxi hoá - khử là Ag+ /Ag và Fe3+/Fe2+.
Chú ý:
- Một kim loại có thể có nhiều cặp oxi hoá - khử và dạng khử không nhất thiết phải là đơn chất kim loại.
Ví dụ: sắt có các cặp oxi hoá - khử là Fe2+/Fe, Fe3+/Fe và Fe3+/Fe2+.
- Khái niệm cặp oxi hoá - khử cũng được sử dụng với phi kim, với phân tử và ion đa nguyên tử.
Ví dụ:
II. THẾ ĐIỆN CỰC CHUẨN CỦA KIM LOẠI
1. Thế điện cực chuẩn
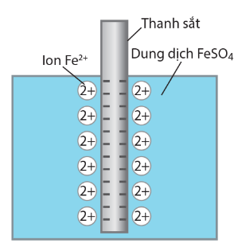
- Khi nhúng thanh kim loại (M) vào dung dịch muối của nó , tạo thành một điện cực. Ở điện cực sẽ xuất hiện một thế điện cực nhất định.
Ví dụ: Khi cho thanh sắt vào dung dịch bề mặt thanh sắt mang điện tích âm do ion Fe2+ từ thanh sắt chuyển vào dung dịch.
- Thế điện cực của cặp oxi hoá – khử của kim loại trong điều kiện chuẩn (nồng độ ion kim loại trong dung dịch là 1M, nhiệt độ 25oC) được coi là thế điện cực chuẩn của kim loại (hay thế khử chuẩn của kim loại), được kí hiệu là .
- Đơn vị thường dùng của thế điện cực là volt (V).
- Thế điện cực chuẩn của cặp oxi hoá – khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hoá của dạng oxi hoá càng mạnh và ngược lại.
Ví dụ: Thế điện cực chuẩn của cặp là 0,799 (tương đối lớn đối với cặp oxi hoá – khử của kim loại), chứng tỏ tính khử của kim loại Ag yếu, tính oxi hoá của ion mạnh.
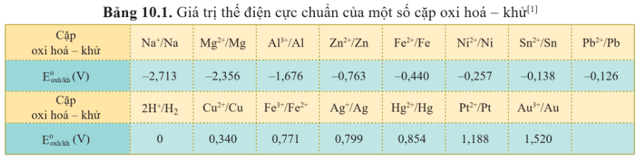
2. Bảng thế điện cực chuẩn của kim loại và ứng dụng
Khi biết thế điện cực chuẩn của kim loại, có thể so sánh được tính oxi hoá và tính khử giữa các cặp oxi hoá – khử cũng như dự đoán được chiều của phản ứng oxi hoá – khử.
a) So sánh tính oxi hoá và tính khử giữa các cặp oxi hoá – khử
Kim loại M có tính khử càng mạnh thì dạng oxi hoá có tính oxi hoá càng yếu, thế điện cực chuẩn của cặp oxi hoá – khử càng nhỏ và ngược lại. Như vậy:
|
- Nếu càng lớn thì: |
- Nếu thì: |
|
+ Tính oxi hoá của Mn+ càng mạnh. + Tính khử của M càng yếu. |
+ Tính khử của X mạnh hơn tính khử của Y. + Tính oxi hoá của Xm+ yếu hơn tính oxi hoá của Yn+. |
Ví dụ: Thế điện cực chuẩn của cặp Fe2+/Fe và Cu2+/Cu tương ứng là −0,440 V và 0,340 V, chứng tỏ tính khử của Fe mạnh hơn Cu và tính oxi hoá của Fe2+ yếu hơn tính của Cu2+.
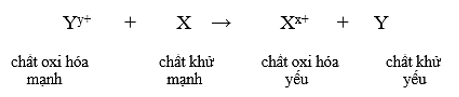
b) Dự đoán chiều của phản ứng oxi hoá – khử (quy tắc alpha)
- Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
- Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa). Xác định chiều của phản ứng oxi hóa khử theo các bước sau:
Bước 1: Viết hai cặp oxi hóa – khử theo đúng thứ tự trong dãy điện hóa:
Bước 2: Áp dụng quy tắc alpha (α)
Phản ứng xảy ra theo chiều mũi tên như sau:
Bước 3: Xác định chiều phản ứng
Phản ứng xảy ra như sau:
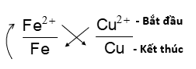
∎ Ví dụ: Xác định chiều phản ứng xảy ra giữa hai cặp Fe2+/ Fe và Cu2+/ Cu.
Hướng dẫn:
Bước 1: Theo trật tự dãy điện hóa có cặp Fe2+/ Fe đứng trước cặp Cu2+/ Cu.
Bước 2: Áp dụng quy tắc alpha:
Bước 3: Xác định chiều phản ứng:
Cu2+ + Fe → Cu + Fe2+
Phản ứng xảy ra theo chiều ion Cu2+ oxi hóa Fe để tạo ra Fe2+ và Cu.
Mở rộng: Trên cơ sở so sánh giá trị thế điện cực chuẩn, các cặp oxi hoá – khử Mn+/M được sắp xếp thành dãy theo chiều tăng dần thế điện cực chuẩn, thường gọi là dãy điện hoá của kim loại.
Thông qua dãy điện hoá có thể so sánh tính khử, tính oxi hoá giữa các cặp oxi hoá – khử.
Ví dụ: Dựa vào dãy điện hoá, thấy Fe2+ đứng trước Cu2+, có thể kết luận:
+ Tính oxi hoá của Fe2+ yếu hơn tính oxi hoá của Cu2+.
+ Tính khử của Fe mạnh hơn tính khử của Cu.