C3H8 → CH4 + C2H4 - Cân bằng phương trình hoá học
Phản ứng hoá học:
C3H8 → CH4 + C2H4
Điều kiện phản ứng
- Nhiệt độ cao.
- Xúc tác: Ni, Fe, Cr2O3, Pt...
Cách thực hiện phản ứng
- Dưới tác dụng của nhiệt cao và có xúc tác thích hợp C3H8 có thể bị phân hủy thành CH4 và C2H4
Hiện tượng nhận biết phản ứng
- Dẫn hỗn hợp sản phẩm thu được qua bình đựng dung dịch brom thấy dung dịch brom bị nhạt màu.
Bạn có biết
- Phản ứng trên được gọi là phản ứng cracking, ngoài CH4 và C2H4 sản phẩm sinh ra có thể có cả H2 và C3H6.
- Dù phản ứng xảy ra theo hướng nào thì phản ứng không làm thay đổi khối lượng hỗn hợp: mtrước phản ứng = msau phản ứng.
- Phản ứng luôn làm tăng số mol khí: nsau > ntrước

Ví dụ minh họa
Ví dụ 1: Crackinh C3H8 thu được hỗn hợp X gồm H2, C2H4, CH4, C3H6, C3H8 có dX/He = 10. Hiệu suất phản ứng là:
A. 10%
B. 80%.
C. 70%.
D. 60%
Hướng dẫn.
Cracking C3H8:
C3H8 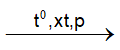
x x x mol
C3H8 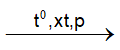
y y y mol
Ta thấy trong X còn lại 1 phần C3H8 chưa bị crackinh hết.
MX = MHe.10 = 4.10 = 40 g/mol
Giả sử có 1 mol C3H8.
Bảo toàn khối lượng có: mtrước = msau hay 1.44 = nx.40 → nx = 1,1 mol
Theo các PTHH có nC3H8pư = nsau - ntrước = 1,1 - 1 = 0,1 mol
Vậy 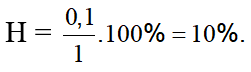
Đáp án A.
Ví dụ 2: Crackinh 8,8 gam propan thu được hỗn hợp A gồm H2, CH4, C2H4, C3H6 và một phần propan chưa bị craking. Biết hiệu suất phản ứng là 90%. Khối lượng phân tử trung bình của A là:
A. 39,6
B. 23,16
C. 2,315
D. 3,96
Hướng dẫn.
Cracking C3H8:
C3H8 → CH4 + C2H4
C3H8 → H2 + C3H6
Có thể nhận thấy cứ mất 1 mol C3H8 sẽ tạo thành 2 mol sản phẩm. Mà nC3H8 = 0.2 mol
Hiệu suất H = 90%
⇒ số mol sp tạo thành là: 0,2.90%.2 = 0.36 mol;
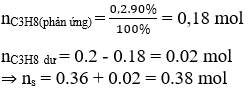
Bảo toàn khối lượng, tổng khối lượng các chất sau cracking vẫn là 8.8 gam
Do đó, khối lượng mol hỗn hợp sau là:
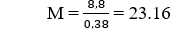
Đáp án B.
Ví dụ 3: Craking m gam propan thu được hợp A gồm H2, CH4, C2H4, C2H6 và một phần propan chưa bị craking. Đốt cháy hoàn toàn A thu được 9 gam H2O và 17,6 gam CO2. Giá trị của m là:
A. 4,4g
B. 6,6g
C. 8,8g
D. 11g
Hướng dẫn
Sản phẩm sinh ra khi đốt cháy A tương tự như đốt cháy propan
npropan = nH2O – nCO2 = 9/18 - 17,6/44 = 0,1 mol
⇒ mpropan = m = 0,1.44 = 4,4 gam
Đáp án A.

