2Al(OH)3 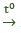 Al2O3 + 3H2O - Cân bằng phương trình hoá học
Al2O3 + 3H2O - Cân bằng phương trình hoá học
Phản ứng hoá học:
2Al(OH)3 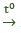
Điều kiện phản ứng
- Điều kiện nhiệt độ cao.
Cách thực hiện phản ứng
- Cho chất rắn Al(OH)3 nhiệt phân.
Hiện tượng nhận biết phản ứng
- Dung dịch keo trắng nhôm hidroxit (Al(OH)3) chuyển thành chất rắn màu trắng nhôm oxit (Al2O3).
Bạn có biết
- Tương tự Al(OH)3 một số bazơ khác như Cu(OH)2; Al(OH)3,… cũng bị nhiệt phân hủy cho oxit và nước. Bazơ không tan bị nhiệt phân hủy tạo thành oxit và nước.

Ví dụ minh họa
Ví dụ 1: Cho 4 chất sau: Al, AlCl3, Al(OH)3, Al2O3. Hãy sắp xếp 4 chất này thành 1 dãy biến hóa (gồm 4 chất)?
A. Al → AlCl3 → Al(OH)3 → Al2O3.
B. Al(OH)3 → Al → AlCl3 → Al2O3.
C. Al2O3 → Al(OH)3 → Al → AlCl3.
D. AlCl3 → Al2O3 → Al → Al(OH)3.
Hướng dẫn giải
Chọn A.
2Al + 3Cl2 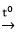
AlCl3 + NaOH → Al(OH)3 + 3NaCl
2Al(OH)3 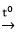
Ví dụ 2: Nhôm hidroxit (Al(OH)3) là hợp chất không bền với nhiệt, khi đun nóng bị phân hủy thành:
A. H2O và Al.
B. H2O và Al2O3.
C. H2 và Al2O3.
D. O2 và AlH3.
Hướng dẫn giải
Chọn B.
2Al(OH)3 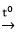
Ví dụ 3:Nung 15,6 gam Al(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được m gam một oxit. Giá trị của m là:
A. 20,4.
B. 15,3.
C. 10,2.
D. 5,1.
Hướng dẫn giải
Chọn C.
2Al(OH)3 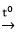
⇒ nAl2O3=0,1 mol ⇒ mAl2O3=0,1.102=10,2 gam

