Giải SBT Hóa học 10 trang 14 Cánh diều
Haylamdo biên soạn và sưu tầm lời giải SBT Hóa học 10 trang 14 trong Bài 5: Lớp, phân lớp và cấu hình electron sách Cánh diều. Với lời giải chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập SBT Hóa học 10.
Giải SBT Hóa học 10 trang 14 Cánh diều
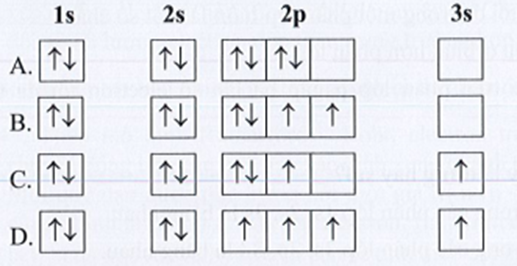
Bài 5.7 trang 14 sách bài tập Hóa học 10: Nguyên tử O có 8 electron. Biểu diễn sự sắp xếp electron trong nguyên tử O theo orbital nào sau đây là đúng?
Lời giải:
Đáp án đúng là: B
Cách biểu diễn cấu hình electron theo orbital:
- Viết cấu hình electron của nguyên tử.
- Biểu diễn mỗi AO bằng một ô vuông, các AO trong cùng một phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các ô orbital từ trái sang phải theo thứ tự như ở cấu hình electron.
- Điền electron vào từng ô AO theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng 1 mũi tên.
+ Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất.
+ Electron được điền vào các ô orbital theo thứ tự từ trái sang phải.
+ Trong một ô AO, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
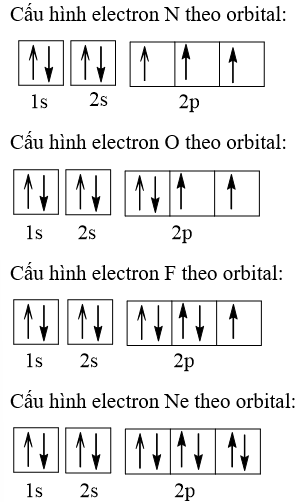
Sự sắp xếp electron trong nguyên tử O theo orbital là:
Bài 5.8 trang 14 sách bài tập Hóa học 10: Các nguyên tử Ne, Na và F có Z lần lượt là 10, 11 và 9. Cấu hình electron của Ne, Na+ và F- tương ứng là:
A. 1s22s22p6; 1s22s22p63s1 và 1s22s22p5.
B. đều có cấu hình 1s22s22p6.
C. 1s22s22p6; 1s22s22p5 và 1s22s22p4.
D. 1s22s22p6; 1s22s22p5; 1s22s22p3.
Lời giải:
Đáp án đúng là: B
- Ne (Z = 10) có cấu hình electron: 1s22s22p6.
- Na (Z = 11) có cấu hình electron: 1s22s22p63s1
Na nhường 1 electron để tạo thành ion Na+.
Cấu hình electron của Na+ là: 1s22s22p6.
- F (Z = 9) có cấu hình electron: 1s22s22p5
F nhận 1 electron để tạo thành ion F-.
Cấu hình electron của F- là: 1s22s22p6.
Bài 5.9 trang 14 sách bài tập Hóa học 10: Biết rằng điện tích hạt nhân của C, N, O và F lần lượt là 6, 7, 8, 9. Ghép mỗi cấu hình electron ở cột A với nguyên tử/ ion thích hợp ở cột B.
Lời giải:
a ghép với 2; b ghép với 1; c ghép với 4; d ghép với 3.
Giải thích:
1. O (Z = 8) có cấu hình electron 1s22s22p4.
2. C (Z = 6) có cấu hình electron 1s22s22p2
C nhường 2 electron được ion C2+ có cấu hình electron: 1s22s2.
3. N (Z = 7) có cấu hình electron 1s22s22p3
N nhận 3 electron được ion N3- có cấu hình electron 1s22s22p6.
4. F (Z = 9) có cấu hình electron: 1s22s22p5.
Bài 5.10 trang 14 sách bài tập Hóa học 10: Trong các nguyên tử N (Z = 7), O (Z = 8), F (Z = 9) và Ne (Z = 10), nguyên tử có nhiều electron độc thân nhất là
A. N.
B. O.
C. F.
D. Ne.
Lời giải:
Đáp án đúng là: A
Vậy nguyên tử N có nhiều electron độc thân nhất (3 electron độc thân).
Bài 5.11 trang 14 sách bài tập Hóa học 10: Nối mỗi cấu hình electron của nguyên tử ở cột A với các loại nguyên tố hóa học thích hợp ở cột B.
Lời giải:
a ghép với 3; b và d ghép với 2; c ghép với 1.
Giải thích:
a) 1s22s22p6: Nguyên tử có 8 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố khí hiếm.
b) 1s22s22p5: Nguyên tử có 7 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố phi kim.
c) 1s22s22p63s1: Nguyên tử có 1 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
d) 1s22s22p63s23p3: Nguyên tử có 5 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố phi kim.
Lời giải sách bài tập Hóa học lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron Cánh diều hay khác: