Giải SBT Hóa học 10 trang 33 Cánh diều
Haylamdo biên soạn và sưu tầm lời giải SBT Hóa học 10 trang 33 trong Bài 11: Liên kết cộng hóa trị sách Cánh diều. Với lời giải chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập SBT Hóa học 10.
Giải SBT Hóa học 10 trang 33 Cánh diều
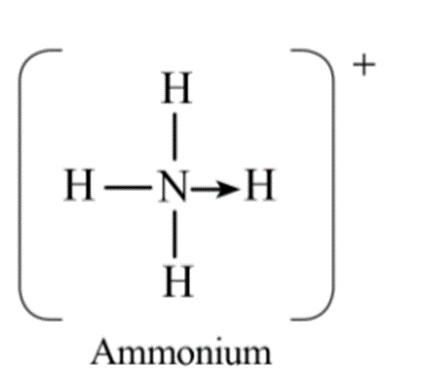
Bài 11.19 trang 33 sách bài tập Hóa học 10: Cho biết hóa trị của một nguyên tố trong phân tử bằng tổng số liên kết σ và π mà nguyên tử nguyên tố đó tạo thành khi liên kết với các nguyên tử xung quanh. Hóa trị của N trong NH4+ là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: D
Công thức cấu tạo của NH4+ là:
Hóa trị của N trong NH4+ là 4.
Bài 11.20 trang 33 sách bài tập Hóa học 10: Cho biết năng lượng liên kết H – I và H – Br lần lượt là 297 kJ mol-1 và 364 kJ mol-1. Những phát biểu nào sau đây là không đúng?
A. Khi đun nóng, HI bị phân hủy (thành H2 và I2) ở nhiệt độ thấp hơn so với HBr (thành H2 và Br2).
B. Liên kết H – Br là bền vững hơn so với liên kết H – I.
C. Khi đun nóng, HI bị phân hủy (thành H2 và I2) ở nhiệt độ cao hơn so với HBr (thành H2 và Br2).
D. Liên kết H – I là bền vững hơn so với liên kết H – Br.
Lời giải:
Đáp án đúng là: C và D.
Chú ý: Năng lượng liên kết càng thấp, liên kết càng kém bền và càng dễ bị phá vỡ.
Bài 11.21 trang 33 sách bài tập Hóa học 10: Cho biết năng lượng liên kết H – H là 436 kJ mol-1. Hãy tính năng lượng cần thiết (theo eV) để phá vỡ liên kết trong một phân tử H2, cho biết 1 eV = 1,602 × 10-19 J.
Lời giải:
1 mol H2 chứa 6,02 × 1023 phân tử H2.
436 kJ = 436 × 103 J.
Năng lượng cần thiết để phá vỡ liên kết trong một phân tử H2 là:
Năng lượng cần thiết (theo eV) để phá vỡ liên kết trong một phân tử H2 là:
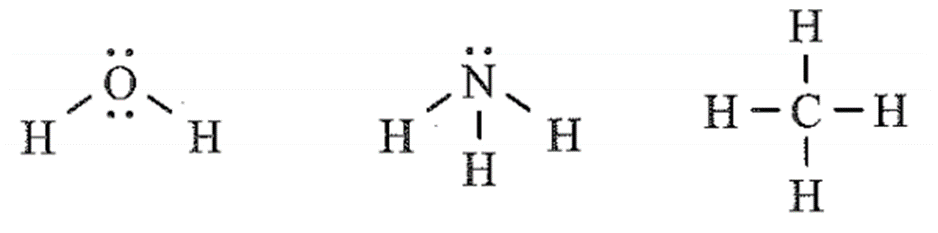
Bài 11.22 trang 33 sách bài tập Hóa học 10: Thiết lập công thức Lewis cho các phân tử H2O, NH3 và CH4. Mỗi phân tử này có bao nhiêu cặp electron hóa trị riêng?
Lời giải:
Công thức Lewis của các phân tử H2O, NH3 và CH4:
Số cặp electron riêng của H2O, NH3 và CH4 lần lượt là: 2, 1 và 0.
Bài 11.23 trang 33 sách bài tập Hóa học 10: Sử dụng bảng năng lượng của một số liên kết ở điều kiện chuẩn (Phụ lục 2, SGK Hóa học 10, Cánh Diều):
a) Tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ bắt đầu phân hủy thành nguyên tử hai chất trên là 400oC và 1 000oC. Theo em, nhiệt độ phân hủy của chất nào cao hơn? Vì sao?
Lời giải:
a) Tổng năng lượng liên kết là 2EH – X với X là S, O.
Tổng năng lượng liên kết trong phân tử H2S là: 2 × 368 = 736 (kJ mol-1)
Tổng năng lượng liên kết trong phân tử H2O là: 2 × 464 = 928 (kJ mol-1)
b) Nhiệt độ bắt đầu phân hủy của H2O cao hơn do liên kết H – O bền hơn liên kết H – S.
Bài 11.24 trang 33 sách bài tập Hóa học 10: Các phân tử như F2, N2 khi phản ứng với H2 thì cần cắt đứt liên kết giữa các nguyên tử. Dựa vào năng lượng liên kết, dự đoán phản ứng của F2 hay của N2 với H2 sẽ thuận lợi hơn (dễ xảy ra hơn). Bỏ qua ảnh hưởng của độ bền phân tử sản phẩm tới mức độ phản ứng.
Lời giải:
Năng lượng liên kết F – F là 159 kJ mol-1, năng lượng liên kết N ≡ N là 946 kJ mol-1 nên phân tử F2 sẽ dễ tham gia phản ứng với H2 hơn so với N2 do liên kết F – F dễ bị phá vỡ hơn.
Bài 11.25 trang 33 sách bài tập Hóa học 10: Giải thích vì sao ở điều kiện thường không tồn tại phân tử NaCl riêng biệt mà là tinh thể NaCl.
Lời giải:
Bản chất liên kết ion trong NaCl là lực hút tĩnh điện giữa các ion mang điện tích trái dấu, không có tính định hướng.
Do vậy, một ion Na+ có thể hút nhiều ion Cl- xung quanh nó và ngược lại, dẫn tới ở điều kiện thường trong tinh thể NaCl, một ion được bao quanh bởi nhiều ion trái dấu thay vì phân tử NaCl chỉ có 2 ion.
Lời giải sách bài tập Hóa học lớp 10 Bài 11: Liên kết cộng hóa trị Cánh diều hay khác: