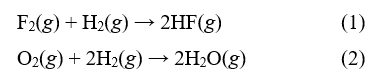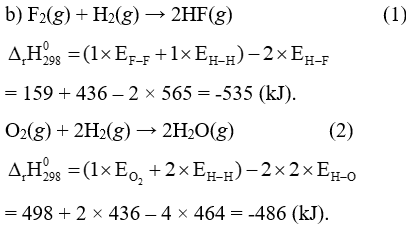Giải SBT Hóa học 10 trang 61 Cánh diều
Haylamdo biên soạn và sưu tầm lời giải SBT Hóa học 10 trang 61 trong Bài 17: Nguyên tố và đơn chất halogen sách Cánh diều. Với lời giải chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập SBT Hóa học 10.
Giải SBT Hóa học 10 trang 61 Cánh diều
Bài 17.20 trang 61 sách bài tập Hóa học 10: Từ bảng giá trị năng lượng liên kết (kJ mol-1) dưới đây:
Hãy cho biết:
a) Liên kết nào bền nhất, liên kết nào kém bền nhất?
b) Giá trị biến thiên enthalpy chuẩn của hai phản ứng sau là bao nhiêu?
c) Trong hai phản ứng (1) và (2), phản ứng nào tỏa nhiệt nhiều hơn?
Lời giải:
a) Liên kết bền nhất là H – F. Năng lượng liên kết càng lớn thì liên kết càng bền.
c) Phản ứng (1) tỏa nhiều nhiệt hơn. Phản ứng có giá trị biến thiên enthalpy chuẩn âm hơn thì sẽ tỏa nhiệt nhiều hơn.
Bài 17.21 trang 61 sách bài tập Hóa học 10: Người ta thường tách bromine trong rong biển bằng quá trình sục khí chlorine vào dung dịch chiết chứa ion bromide. Phương trình hóa học của phản ứng có thể được mô tả dạng thu gọn như sau:
2Br-(aq) + Cl2(aq) → 2Cl-(aq) + Br2(aq)
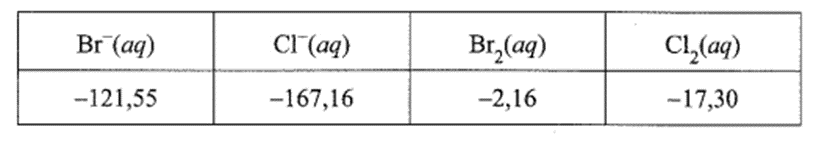
Cho các số liệu enthalpy tạo thành chuẩn trong bảng dưới đây:
a) Tính biến thiên enthalpy chuẩn phản ứng trên.
b) Phản ứng trên có thuận lợi về năng lượng không?
Lời giải:
a) Với phản ứng:
2Br-(aq) + Cl2(aq) → 2Cl-(aq) + Br2(aq)
Dựa vào enthalpy tạo thành chuẩn của các chất, biến thiên enthalpy chuẩn của phản ứng được tính như sau:
= 2 × (-167,16) + (-2,16) – 2 × (-121,55) – (-17,3) = -76,08 (kJ).
b) Đây là phản ứng tỏa nhiệt nên thuận lợi về mặt năng lượng. Thực tế phản ứng trên diễn ra dễ dàng.
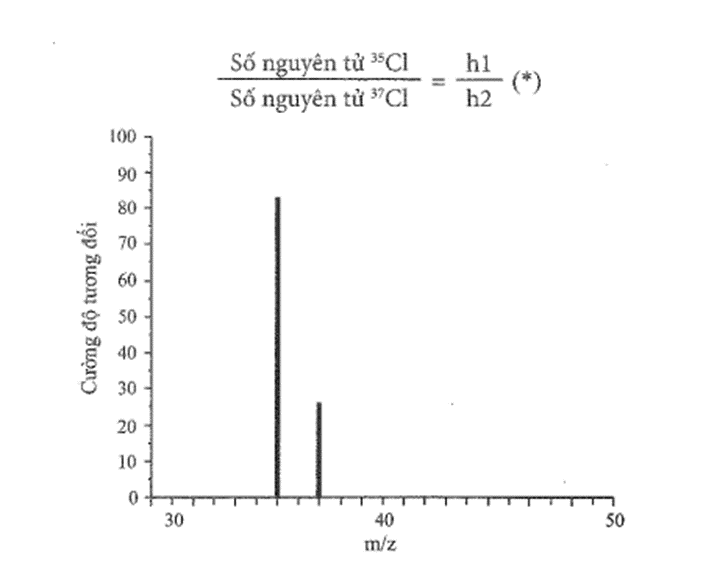
Bài 17.22 trang 61 sách bài tập Hóa học 10: Hình sau đây là một phần phổ khối lượng của chlorine. Phổ này có hai tín hiệu, là hai đường thẳng xuất phát từ tọa độ 35 và 37 trên trục hoành. Nhờ đó, người ta biết được nguyên tố chlorine có hai đồng vị bền là 35Cl và 37Cl.
Tỉ lệ số nguyên tử của hai đồng vị cũng là tỉ lệ độ cao h1 và h2 (hay tỉ lệ cường độ tương đối) của hai tín hiệu:
a) Dùng thước (độ chia nhỏ nhất là mm) để đo h1 và h2. Từ đó tính tỉ lệ h1 : h2.
b) Số nguyên tử đồng vị 35Cl gấp bao nhiêu lần số nguyên tử đồng vị 37Cl?
c) Xác định phần trăm số nguyên tử của mỗi đồng vị?
d) Xác định nguyên tử khối trung bình của chlorine.
Lời giải:
a) Dùng thước ta đo được:
h1 = 50 mm; h2 = 15 mm.
Vậy h1 : h2 = 50 : 15 = 10 : 3.
b) Số nguyên tử đồng vị 35Cl gấp lần số nguyên tử đồng vị 37Cl.
c) Phần trăm số nguyên tử của mỗi đồng vị là:
%37Cl = 100% - 76,9% = 23,1%.
d) Nguyên tử khối trung bình của chlorine là:
Lời giải sách bài tập Hóa học lớp 10 Bài 17: Nguyên tố và đơn chất halogen Cánh diều hay khác: