Giải SBT Hóa 10 trang 26 Kết nối tri thức
Haylamdo biên soạn và sưu tầm lời giải Giải SBT Hóa 10 trang 26 sách Kết nối tri thức. Với lời giải chi tiết nhất hy vọng sẽ giúp học sinh dễ dàng nắm được cách làm bài tập Sách bài tập Hóa học 10.
Giải SBT Hóa học 10 trang 26 Kết nối tri thức
Bài 9.12 trang 26 SBT Hóa học 10: Hãy so sánh và giải thích kích thước tương đối của:
a) nguyên tử lithium và nguyên tử fluorine.
b) nguyên tử lithium và ion của nó (Li+).
c) nguyên tử oxygen và ion của nó (O2-).
d) ion nitride (N3-) và ion fluoride (F-).
Lời giải:
a) Li và F nằm trong cùng chu kì 2. Trong chu kì, khi điện tích hạt nhân tăng (số electron lớp ngoài cùng tăng), lực hút giữa hạt nhân với electron ngoài cùng tăng dẫn đến bán kính nguyên tử giảm. Bán kính nguyên tử Li > F.
b) Li → Li+ + e
Khi một nguyên tử Li nhường 1 electron để tạo thành ion dương, các electron còn lại bị hút mạnh hơn về phía hạt nhân làm cho bán kính ion giảm. Ở ion Li+, sự giảm bán kính là đặc biệt lớn khi cả lớp electron ngoài cùng bị mất đi (khi đó lớp electron thứ nhất, lớp K trở thành lớp ngoài cùng).
Bán kính cation luôn nhỏ hơn bán kính của nguyên tử tương ứng:
c) O + 2e → O2-
Khi nguyên tử O nhận thêm electron để tạo thành anion, điện tích dương của hạt nhân không đổi, điện tích âm tăng nên electron bị hút vào hạt nhân yếu hơn, ngoài ra electron được nhận thêm làm tăng tương tác đẩy electron – electron, làm cho kích thước nguyên tử tăng lên.
Bán kính anion luôn lớn hơn bán kính của nguyên tử tương ứng:
d) Hai ion N3- và F- của hai nguyên tố ở cùng chu kì 2. Sự giảm bán kính ion của các nguyên tố trong chu kì còn mạnh hơn sự giảm bán kính nguyên tử, là do các ion đều có cùng số electron lớp ngoài cùng, điện tích hạt nhân tăng lên sẽ tương tác với cùng một số electron làm co kích thước dần.
Bán kính ion: N3- > F-
Bài 9.13 trang 26 SBT Hóa học 10: Ba nguyên tố X, Y, Z thuộc cùng một chu kì và có tổng số hiệu nguyên tử là 39. Số hiệu của nguyên tử Y bằng trung bình cộng số hiệu của nguyên tử X và Z. Nguyên tử của ba nguyên tố này hầu như không phản ứng với H2O ở điều kiện thường.
a) Hãy xác định vị trí của X, Y, Z trong bảng tuần hoàn. Viết cấu hình electron nguyên tử và gọi tên từng nguyên tố.
a) Hãy xác định vị trí của X, Y, Z trong bảng tuần hoàn. Viết cấu hình electron nguyên tử và gọi tên từng nguyên tố.
b) So sánh độ âm điện, bán kính nguyên tử của X, Y, Z.
c) So sánh tính base của các hydroxide của X, Y, Z.
Lời giải:
a) Gọi số hiệu nguyên tử của các nguyên tố X, Y, Z lần lượt là P1, P2, P3.
Trong đó P1 < P2 < P3. Ta có: P1 + P2 + P3 = 39 (I)
Và P2 = (III)
Giải hệ (I) và (II), ta được: P2 = 13
Y là nhôm (Al).
Cấu hình electron của Y: 1s22s22p63s22p1.
Ta có P1 < 13 < P3 và X, Y, Z thuộc cùng một chu kì nên P1 ≥ 11
⇒ P1 = 11 hoặc P1 = 12.
Khi P1 = 11 thì X là Na (sodium) không phù hợp vì Na tác dụng với nước ngay ở điều kiện thường.
Vậy X là Mg (magnesium), có P1 = 12 và cấu hình electron: 1s22s22p63s2.
⇒ P3 = 14 và Z là Si (silicon), có cấu hình electron: 1s22s22p63s23p2.
b) Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của các nguyên tố tăng dần, bán kính nguyên tử giảm dần:
- Độ âm điện: Mg < Al < Si.
- Bán kính nguyên tử: Mg > Al > Si
c) Tính base: Mg(OH)2 > Al(OH)3 > H2SiO3.H2O
Mg(OH)2 là một base yếu, Al(OH)3 là hydroxide lưỡng lưỡng tính và H2SiO3.H2O là một acid yếu.
Bài 9.14 trang 26 SBT Hóa học 10: Quá trình sản xuất aluminium từ quặng bauxite gồm tinh thể bauxite và trộn Al2O3 thu được với cryolite (Na3AlF6) rồi điện phân nóng chảy. Trường hợp bể điện phân chưa đúng tiêu chuẩn, sản phẩm là Al có lẫn Na. Cho 1,0 g hỗn hợp sản phẩm phản ứng với dung dịch sulfuric acid loãng, dư, thoát ra 1336,7 mL khí hydrogen (25oC và 1 bar).
a) Xác định độ tinh khiết của aluminium trong sản phẩm.
b) Viết công thức oxide ứng với hóa trị cao nhất, hydroxide tương ứng của các kim loại trên.
c) So sánh tính acid – base giữa oxide, hydroxide tương ứng đó. Giải thích.
Lời giải:
a) Gọi số mol Na, Al lần lượt là x và y.
Số mol H2 = .
Theo phương trình hóa học: 1 mol Na giải phóng 0,5 mol H2
1 mol Al giải phóng 1,5 mol H2.
⇒ 0,5x + 1,5y = 0,0547 (I)
Theo bài ra ta có: 23x + 27y = 1,0 (II)
Giải hệ (I) và (II), ta được: x = 0,0011, y = 0,0361.
Khối lượng Al là: Na2O và Al2O3; hydroxide tương ứng: NaOH và Al(OH)3.
c) Na2O là basic oxide mạnh, còn Al2O3 là oxide lưỡng tính.
NaOH là base mạnh còn Al(OH)3 là hydroxide lưỡng tính.
So sánh tính base: Na2O > Al2O3 và NaOH > Al(OH)3.
Bài 9.15 trang 26 SBT Hóa học 10: Oxide ứng với hóa trị cao nhất của một nguyên tố có công thức thực nghiệm là R2O5. Oxide này là một chất hút nước mạnh, được sử dụng trong tổng hợp chất hữu cơ. Khả năng hút ẩm của nó đủ mạnh để chuyển nhiều acid vô cơ thành các alhydrite (oxide tương ứng) của chúng. Hợp chất khí của R với hydrogen có chứa 8,82% khối lượng hydrogen và là chất khí không màu, rất độc, kém bền, sinh ra trong quá trình phân hủy xác động thực vật.
a) Nêu vị trí của R trong bảng tuần hoàn.
b) Viết cấu hình electron theo ô orbital của nguyên tử R.
c) Nêu một số tính chất hóa học cơ bản của R và hợp chất.
Lời giải:
a) Hợp chất khí của R với hydrogen có dạng RH3.
Ta có: ⇒ R = 31. R là P (phosphorus)
Vị trí trong bảng tuần hoàn của R: ô số 15, chu kì 3, nhóm VA.
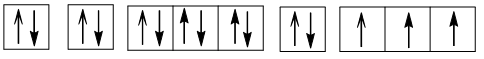
b) Cấu hình electron của R: 1s22s22p63s23p3
c) - Tính chất đơn chất: nguyên tố P là phi kim trung bình:
+ Phản ứng với oxygen tạo oxide.
+ Phản ứng với chlorine tạo phosphorus chloride.
+ Phản ứng với kim loại tạo phosphide.
- Tính chất hợp chất: P2O5 là acidic oxide phản ứng với nước tạo hydroxide tương ứng H3PO4 là acid.
Lời giải Sách bài tập Hóa học lớp 10 Bài 9: Ôn tập chương 2 Kết nối tri thức hay khác: