Trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 1 (Bài kiểm tra số 1) có đáp án năm 2021
Trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 1 (Bài kiểm tra số 1) có đáp án năm 2021
Với bộ bài tập trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 1 (Bài kiểm tra số 1) có đáp án năm 2021 sẽ giúp học sinh hệ thống lại kiến thức bài học và ôn luyện để đạt kết quả cao trong các bài thi môn Hóa lớp 10.
Câu 1: Cho biết lựa chọn nào dưới đây có sự kết hợp đúng giữa tên nhà khoa học và công trình nghiên cứu của họ.
| A | Tôm-sơn (Thomson) | Tìm ra hạt nơtron trong hạt nhân |
| B | Bo (Bohr) | Tìm ra hạt proton trong hạt nhân |
| C | Rơ-dơ-pho (Rutherford) | Tìm ra hạt nhân nguyên tử |
| D | Chat-uých (Chadwick) | Tìm ra hạt electron |
Đáp án: C
Câu 2: Phát biểu nào sau đây không đúng?
A. Nguyên tử nhẹ nhất là hidro.
B. Khối lượng nguyên tử hidro xấp xỉ bằng khối lượng của hạt proton và nowtron.
C. Các hạt cơ bản có khối lượng xấp xỉ bằng nhau.
D. Điện tích của hạt electron và hạt proton là điện tích nhỏ nhất được biết đến trong tự nhiên.
Đáp án: C
Câu 3: Trong nguyên tử, lớp electron có mức năng lượng thấp nhất là
A. P. B. K. C. L. D. M.
Đáp án: B
Câu 4: Số electron tối đa trong lớp N là
A. 2. B. 8. C. 18. D. 32.
Đáp án: D
Số electron tối đa trong phân lớp thứ n là 2n2 .
Câu 5: Agon có ba đồng vị có số khối lần lượt là 36, 38 và A. Thành phần phần tram số nguyên tử của các đồng vị tương ứng bằng: 0,34% ; 0,06% ; 99,60%. Nguyên tử khối trung bình của agon là 39,98. Giá trị của A là
A. 40. B. 37. C. 35. D. 41.
Đáp án: A
Từ công thức tính nguyên tử khối trung bình:
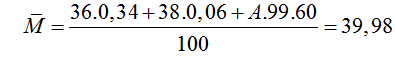
⇒ A = 40.
Câu 6: Các phân lớp electron có trong lớp M là
A. 2s, 2p.
B. 3s, 3p, 3d.
C. 4s, 4p, 4d, 4f.
D. 1s.
Đáp án: B
Câu 7: Nguyên tố X có kí hiệu nguyên tử là 919X. Kết luận nào sau đây về cấu tạo nguyên tử X là đúng?
| Số proton | Số khối | Phân bố electron trong từng lớp | |
| A | 9 | 19 | 2/7 |
| B | 9 | 19 | 2/8/8/1 |
| C | 19 | 9 | 2/7 |
| D | 19 | 9 | 2/8/8/1 |
Đáp án: A
Câu 8: Một nguyên tố A có kí hiệu nguyên tử là 56137A. Nguyên tố này tạo được ion có dạng A2+. Số proton, nơtron và electron rong ion này lần lượt là
A. 58, 79, 56.
B. 56, 81, 54.
C. 58, 77, 56.
D. 56, 79, 54.
Đáp án: B
Câu 9: Một nguyên tố X có 4 đồng vị bền với hàm lượng % lần lượt như sau:
| Đồng vị | 54X | 56X | 57X | 58X |
| Hàm lượng (%) | 5,78 | 91,72 | 2,22 | 0,28 |
Nguyên tử khối trung bình của X là
A. 56,25. B. 55,91. C. 56,00. D. 55,57.
Đáp án: B
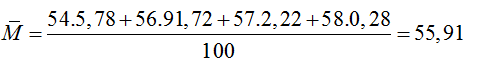
Câu 10: Hợp chất MXa có tổng số proton là 58. Trong hạt nhân M, số nowtron nhiều hơn số proton là 4. Trong hạt nhân X, số proton bằng số nowtron. Phân tử khối của MXa là
A. 116. B. 120. C. 56. D. 128.
Đáp án: B
Ta có số proton của MXa là: pM + a.px = 58
Mặt khác: nM - pM = 4, nX = pX
Coi phân tử khối xấp xỉ bằng số khối.
Vậy phân tử khối của MXa là:
pM + nM+ a(pX + nX) = 2pM+ 2apX + 4 = 120
Câu 11:
Trong số các nguyên tử và ion sau đây, có bao nhiêu hạt có 8 electron ở lớp ngoài cùng?
1939X+ , 1840Y , 1735Z- , 816T , 2040A
A. 2 B. 3 C. 4 D. 5
Đáp án: B
Các hạt 1939X+ , 1840Y , 1735Z- có 8 electron ở lớp ngoài cùng.
Câu 12:
Nguyên tử của nguyên tố Z có kí hiệu 2040Z. Cho các phát biểu sau về Z:
1. Z có 20 nowtron.
2. Z có 20 proton.
3. Z có 2 electron hóa trị.
4. Z có 4 lớp electron.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Đáp án: D
Câu 13:
Nguyên tử của nguyên tố X có 21 electron. Khi mất đi toàn bộ electron hóa trị, điện tích của ion này là
A. 1+ B. 2+ C. 3+ D. 4+
Đáp án: C
Cấu hình electron của X là: 1s22s22p63s23p63d14s2
Vậy nguyên tử X có 3 electron hóa trị (trên phân lớp 3d và 4s). Khi mất đi toàn bộ electron hóa trị này thì điện tích ion là 3+ .
Câu 14:
Nguyên tử của nguyên tố Y có 8 electron. Nếu Y nhận thêm electron để lớp ngoài cùng bão hòa thì điện tích ion thu được là
A. 1-. B. 2-. C. 3-. D. 4-.
Đáp án: B
Cấu hình electron của Y là: 1s22s22p4
Vậy để lớp electron ngoài cùng bão hòa, Y cần nhận thêm 2 electron. Điện tích của ion thu được là 2-
Câu 15:
A và B là hai đồng vị của nguyên tố X. Tổng số hạt trong A và B là 50, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14. Số hiệu nguyên tử X là
A. 8. B. 10. C. 16. D. 32.
Đáp án: A
Vì A và B là 2 đồng vị nên có cùng số proton và số electron. Gọi số nơtron của A và B lần lượt là a và b.
Ta có tổng số hạt trong A và B là 4p + a + b = 50 (1)
Mặt khác: 4p - (a + b) = 14 (2)
Từ (1) và (2) ⇒ 8p = 64 ⇒ p = 8
Câu 16:
Sự phân bố electron trên các lớp của ion X¯ là 2/8/8. X¯ có 18 nowtron trong hạt nhân. Số khối của ion X¯ là
A. 34. B. 35. C. 36. D. 37.
Đáp án: B
Ion X có 18 electron ⇒ Nguyên tử X có 17 electron trong vỏ nguyên tử và có 17 proton trong hạt nhân.
Vậy số khối của X là 35.
Câu 17:
Nguyên tử của nguyên tố T có cấu hình electron nguyên tử là 1s22s22p63s23p63d54s2. Phát biểu nào sau đây về nguyên tố T không đúng?
A. Cấu hình electron của ion T2+ là [Ar]3d5.
B. Nguyên tử của T có 2 electron hóa trị.
C. T là kim loại.
D. T là nguyên tố d.
Đáp án: B
Nguyên tử có 7 electron hóa trị (5 electron trên phân lớp 3d và 2 electron trên phân lớp 4s).
Câu 18:
Nguyên tử của nguyên tố X có tổng số hạt bằng 73. Số hạt nowtron nhiều hơn số hạt electron là 4. Số electron hóa trị của X là
A. 2. B. 8. C. 7. D. 5.
Đáp án: D
2e + n = 73 và n = e + 4 ⇒ e = 23
Cấu hình electron của X là: 1s22s22p63s23p63d34s2
Vậy X có 5 electron hóa trị (3 electron trên phân lớp 3d và 2 electron trên phân lớp 4s).
Câu 19:
Ion M¯ có cấu hình electron phân lớp ngoài cùng là 3p6. Số proton trong hạt nhân của nguyên tử M là
A. 19. B. 18. C. 17. D. 16.
Đáp án: C
Nguyên tử M có cấu hình electron phân lớp ngoài cùng là 3p5
⇒ Cấu hình electron đầy đủ của M là: 1s22s22p63s23p5
Nguyên tử M có 17 electron ở vỏ nguyên tử và 17 proton trong hạt nhân.
Câu 20:
Ion X+ có cấu hình electron phân lớp ngoài cùng là 4p6. Số khói của ion này là 87. Số hạt nowtron trong nguyên tử X là
A. 48 B. 49 C. 50 D. 51
Đáp án: C
Câu 21: Cho cấu hình của nguyên tử các nguyên tố X1, X2, X3, X4, X5:
X1 : 1s2;
X2 : 1s22s1;
X3 : 1s22s22p63s23p3;
X4 : 1s22s22p63s23p64s2;
X5 : 1s22s22p63s23p63d74s2;
Trong các nguyên tố cho ở trên, số các nguyên tố kim loại là
A. 2 B. 3 C. 4 D. 5
Đáp án: B
Các nguyên tố kim loại là: X2 , X4 , X5.
Câu 22: Nguyên tử của nguyên tố X có tổng số electron p là 7. Kết luận nào sau đây về X là không đúng?
A. X là kim loại.
B. X là nguyên tố d.
C. Trong nguyên tử X có 3 lớp electron.
D. Trong nguyên tử X có 6 electron s.
Đáp án: B
A có 7 electron p Cấu hình electron của A là 1s22s22p63s23p1 .
Vậy A là kim loại nhóm IIIA, có 3 lớp electron và 6 electron s.
Câu 23: Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố X là 21. Tổng số phân lớp electron trong nguyên tử của nguyên tố X là
A. 1 B. 2 C. 3 D. 4
Đáp án: C
Ta có 2p + n = 21 .
Mặt khác, vì 1 ≤ n/p ≤ 1,5 ⇒ 6 ≤ p ≤ 7 .
Nguyên tố cần tìm có số proton và electron bằng 7.
Cấu hình electron là: 1s22s22p3.
Nguyên tố này có 3 phân lớp electron.
Câu 24: Nguyên tử nguyên tô X có 2 electron ở phân lớp 3d. Trong bảng tuần hoàn, nguyên tố X ở ô số
A. 18 B. 24 C. 20 D. 22
Đáp án: D
Cấu hình electron đầy đủ của X là: 1s22s22p63s23p63d24s2
Vậy nguyên tố X có 22 electron và nằm ở ô thứ 22 trong bảng tuần hoàn.
Câu 25: Tổng số hạt proton, nowtron, electron của ion M2+ là 34, biết rằng số hạt mang điện nhiều hơn số hạt không mang điện là 10. Cấu hình electron phân lớp ngoài cùng của nguyên tử M là
A. 2p4
B. 2p6
C. 3s2
D. 3p2
Đáp án: C
Ta có: 2p - 2 + n = 34 và 2p - 2 = n + 10 ⇒ p = 12
Cấu hình electron của M là: 1s22s22p63s2
Câu 26: Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 82, trong đó số hạt mnag điện nhiều hơn số hạt không mang điện là 22. Cấu hình electron của ion X2+ là
A. [Ar]3d44s2
B. [Ar]3d6
C. [Ar]3d54s1
D. [Ar]3d64s1
Đáp án: B
Số electron của X là 26.
Cấu hình electron nguyên tử của X là: 1s22s22p63s23p64s2
Ion X2+ có cấu hình lớp ngoài cùng là 3p6 .
Câu 27: Cho các nguyên tố Q, T, Y, Z có số hiệu nguyên tử lần lượt là 13, 16, 19, 25. Ion nào sau đây không có cấu hình electron của khí hiếm?
A. Q3+
B. T2-
C. Y+
D. Z2+
Đáp án: D
Cấu hình electron của Z là: 1s22s22p63s23p63d54s2
Cấu hình electron của Z2+ là: 1s22s22p63s23p63d5
Câu 28: Cho các dãy nguyên tố mà mỗi nguyên tố được biểu diễn bằng số hiệu nguyên tử tương ứng. Dãy nào sau đây chỉ gồm các nguyên tố kim loại?
A. 8, 11, 26
B. 15, 19, 25
C. 13, 20, 27
D. 5, 12, 14
Đáp án: C
Câu 29: Phát biểu nào sau đây đúng?
A. Các nguyên tử của nguyên tố khí hiếm đều có 8 electron lớp ngoài cùng.
B. Các nguyên tố mà nguyên tử có 1, 2 hoặc 3 electron lớp ngoài cùng đều là kim loại.
C. Các nguyên tố mà nguyên tử có 5, 6 hoặc 7 electron lớp ngoài cùng đều là phi kim.
D. Nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim.
Đáp án: D
Câu 30: Một nguyên tử có 3 phân lớp electron. Trong đó số electron p nhiều hơn số electron s là 5. Số electron lớp ngòi cùng của nguyên tử này là
A. 2 B. 3 C. 5 D. 7
Đáp án: D
Nguyên tử có 3 phân lớp electron nên suy ra có 6 electron s.
Vậy nguyên tử này có 11 electron p.
Cấu hình electron của nguyên tử này là: 1s22s22p63s23p5
Nguyên tử có 7 electron lớp ngoài cùng.


