Bộ bài tập trắc nghiệm Hóa lớp 10 có đáp án năm 2023
Bộ bài tập trắc nghiệm Hóa lớp 10 có đáp án năm 2023
Tài liệu tổng hợp 500 bài tập trắc nghiệm Hóa học lớp 10 năm 2021 chọn lọc, có đáp án chi tiết với các bài tập trắc nghiệm đa dạng đầy đủ các mức độ nhận biết, thông hiểu, vận dụng được biên soạn theo từng bài học sẽ giúp học sinh ôn luyện, củng cố lại kiến thức để đạt điểm cao trong các bài thi môn Hóa lớp 10.
- Trắc nghiệm Thành phần nguyên tử có đáp án năm 2023
- Trắc nghiệm Thành phần nguyên tử có đáp án năm 2023 (phần 2)
- Trắc nghiệm Hạt nhân nguyên tử. Nguyên tố hóa học. Đồng vị có đáp án năm 2023
- Trắc nghiệm Hạt nhân nguyên tử. Nguyên tố hóa học. Đồng vị có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập Thành phần nguyên tử có đáp án năm 2023
- Trắc nghiệm Luyện tập Thành phần nguyên tử có đáp án năm 2023 (phần 2)
- Trắc nghiệm Cấu tạo vỏ nguyên tử có đáp án năm 2023
- Trắc nghiệm Cấu tạo vỏ nguyên tử có đáp án năm 2023 (phần 2)
- Trắc nghiệm Cấu hình electron nguyên tử có đáp án năm 2023
- Trắc nghiệm Cấu hình electron nguyên tử có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập Cấu tạo vỏ nguyên tử có đáp án năm 2023
- Trắc nghiệm Luyện tập Cấu tạo vỏ nguyên tử có đáp án năm 2023 (phần 2)
- Trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 1 (Bài kiểm tra số 1) có đáp án năm 2023
- Trắc nghiệm Bảng tuần hoàn các nguyên tố hóa học có đáp án năm 2023
- Trắc nghiệm Bảng tuần hoàn các nguyên tố hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học có đáp án năm 2023
- Trắc nghiệm Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn có đáp án năm 2023
- Trắc nghiệm Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn có đáp án năm 2023 (phần 2)
- Trắc nghiệm Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học có đáp án năm 2023
- Trắc nghiệm Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học có đáp án năm 2023
- Trắc nghiệm Luyện tập Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 1 (Bài kiểm tra số 2) có đáp án năm 2023
- Trắc nghiệm Liên kết ion - Tinh thể ion có đáp án năm 2023
- Trắc nghiệm Liên kết ion - Tinh thể ion có đáp án năm 2023 (phần 2)
- Trắc nghiệm Liên kết cộng hóa trị có đáp án năm 2023
- Trắc nghiệm Liên kết cộng hóa trị có đáp án năm 2023 (phần 2)
- Trắc nghiệm Tinh thể nguyên tử và tinh thể phân tử có đáp án năm 2023
- Trắc nghiệm Tinh thể nguyên tử và tinh thể phân tử có đáp án năm 2023 (phần 2)
- Trắc nghiệm Hóa trị và số oxi hóa có đáp án năm 2023
- Trắc nghiệm Hóa trị và số oxi hóa có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập Liên kết hóa học có đáp án năm 2023
- Trắc nghiệm Luyện tập Liên kết hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Phản ứng oxi hóa khử có đáp án năm 2023
- Trắc nghiệm Phản ứng oxi hóa khử có đáp án năm 2023 (phần 2)
- Trắc nghiệm Phân loại phản ứng trong hóa học vô cơ có đáp án năm 2023
- Trắc nghiệm Phân loại phản ứng trong hóa học vô cơ có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập Phản ứng oxi hóa - khử có đáp án năm 2023
- Trắc nghiệm Luyện tập Phản ứng oxi hóa - khử có đáp án năm 2023 (phần 2)
- Trắc nghiệm Thực hành Phản ứng oxi hóa khử có đáp án năm 2023
- Trắc nghiệm Thực hành Phản ứng oxi hóa khử có đáp án năm 2023 (phần 2)
- Trắc nghiệm Ôn tập học kì 1 có đáp án năm 2023
- Trắc nghiệm Ôn tập học kì 1 có đáp án năm 2023 (phần 2)
- Trắc nghiệm Đề kiểm tra Học kì 1 Hóa 10 có đáp án
- Trắc nghiệm Khái quát về nhóm halogen có đáp án năm 2023
- Trắc nghiệm Khái quát về nhóm halogen có đáp án năm 2023 (phần 2)
- Trắc nghiệm Clo có đáp án năm 2023
- Trắc nghiệm Clo có đáp án năm 2023 (phần 2)
- Trắc nghiệm Hiđro clorua - Axit clohiđric và muối clorua có đáp án năm 2023
- Trắc nghiệm Hiđro clorua - Axit clohiđric và muối clorua có đáp án năm 2023 (phần 2)
- Trắc nghiệm Sơ lược về hợp chất có oxi của clo có đáp án năm 2023
- Trắc nghiệm Sơ lược về hợp chất có oxi của clo có đáp án năm 2023 (phần 2)
- Trắc nghiệm Flo - Brom - Iot có đáp án năm 2023
- Trắc nghiệm Flo - Brom - Iot có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập nhóm halogen có đáp án năm 2023
- Trắc nghiệm Luyện tập nhóm halogen có đáp án năm 2023 (phần 2)
- Trắc nghiệm Thực hành Tính chất hóa học của khí clo và hợp chất của clo có đáp án năm 2023
- Trắc nghiệm Thực hành Tính chất hóa học của khí clo và hợp chất của clo có đáp án năm 2023 (phần 2)
- Trắc nghiệm Thực hành Tính chất hóa học của brom và iot có đáp án năm 2023
- Trắc nghiệm Thực hành Tính chất hóa học của brom và iot có đáp án năm 2023 (phần 2)
- Trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 2 (Bài kiểm tra số 4) có đáp án năm 2023
- Trắc nghiệm Oxi - Ozon có đáp án năm 2023
- Trắc nghiệm Oxi - Ozon có đáp án năm 2023 (phần 2)
- Trắc nghiệm Lưu huỳnh có đáp án năm 2023
- Trắc nghiệm Lưu huỳnh có đáp án năm 2023 (phần 2)
- Trắc nghiệm Thực hành Tính chất của oxi, lưu huỳnh có đáp án năm 2023
- Trắc nghiệm Thực hành Tính chất của oxi, lưu huỳnh có đáp án năm 2023 (phần 2)
- Trắc nghiệm Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit có đáp án năm 2023
- Trắc nghiệm Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit có đáp án năm 2023 (phần 2)
- Trắc nghiệm Axit sunfuric - Muối sunfat có đáp án năm 2023
- Trắc nghiệm Axit sunfuric - Muối sunfat có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập Oxi và lưu huỳnh có đáp án năm 2023
- Trắc nghiệm Luyện tập Oxi và lưu huỳnh có đáp án năm 2023 (phần 2)
- Trắc nghiệm Thực hành Tính chất các hợp chất của lưu huỳnh có đáp án năm 2023
- Trắc nghiệm Thực hành Tính chất các hợp chất của lưu huỳnh có đáp án năm 2023 (phần 2)
- Trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 2 (Bài kiểm tra số 5) có đáp án năm 2023
- Trắc nghiệm Tốc độ phản ứng hóa học có đáp án năm 2023
- Trắc nghiệm Tốc độ phản ứng hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Thực hành Tốc độ phản ứng hóa học có đáp án năm 2023
- Trắc nghiệm Thực hành Tốc độ phản ứng hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Cân bằng hóa học có đáp án năm 2023
- Trắc nghiệm Cân bằng hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập Tốc độ phản ứng và cân bằng hóa học có đáp án năm 2023
- Trắc nghiệm Luyện tập Tốc độ phản ứng và cân bằng hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Ôn tập học kì 2 có đáp án năm 2023
- Trắc nghiệm Ôn tập học kì 2 có đáp án năm 2023 (phần 2)
- Trắc nghiệm Đề kiểm tra Học kì 2 Hóa học 10 có đáp án năm 2023
Trắc nghiệm Thành phần nguyên tử có đáp án năm 2023
Câu 1: Nguyên tử X có 26 proton trong hạt nhân.
Cho các phát biểu sau về X:
X có 26 nơtron trong hạt nhân.
X có 26 electron ở vỏ nguyên tử.
X có điện tích hạt nhân là 26+.
Khối lượng nguyên tử X là 26u.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Đáp án: B
Phát biểu 2 và 3 đúng.
Câu 2: Nguyên tử vàng có 79 electron ở vỏ nguyên tử. Điện tích hạt nhân của nguyên tử vàng là
A. +79. B. -79. C. -1,26.10-17 C. D. +1,26.10-17 C.
Đáp án: D
Điện tích hạt nhân là +1,26.10-17 C, hoặc kí hiệu là 79+.
Câu 3: Một nguyên tử có 12 proton và 12 nơtron trong hạt nhân. Điện tích của ion tạo thành khi nguyên tử này bị mất 2 electron là
A. 2+. B. 12+. C. 24+. D. 10+.
Đáp án: A
Câu 4: Nguyên tử natri có 11 electron ở vỏ nguyên tử và 12 nơtron trong hạt nhân. Tỉ số khối lượng giữa hạt nhân và nguyên tử natri là
A. ≈ 1,0. B. ≈ 2,1. C. ≈ 0,92. D. ≈ 1,1.
Đáp án: A
Nguyên tử Na có 11 electron ở lớp vỏ nguyên tử, 11 proton và 12 nowtron trong hạt nhân.
Vì me ≈ 9,1. 10-31 kg và mn ≈ mp ≈ 1,67.10-27 kg.
me << mn và mp.
Như vậy, coi như khối lượng nguyên tử tập trung ở hạt nhân.
Câu 5: Tưởng tượng ta có thể phóng đại hạt nhân thành một quả bóng bàn có đường kính 4 cm thì đường kính của nguyên tử là bao nhiêu? Biết rằng đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 104 lần.
A. 4m. B. 40 m. C. 400 m. D. 4000 m.
Đáp án: C
Nếu đường kính hạt nhân là 4cm thì đường kính nguyên tử khoảng:
4.104 cm = 400 m
Câu 6: Một nguyên tử chỉ có 1 electron ở vỏ nguyên tử và hạt nhân nguyên tử có khối lượng là 5,01.10-24 gam. Số hạt proton và hạt nowtron trong hạt nhân nguyên tử này lần lượt là
A. 1 và 0. B. 1 và 2.
C. 1 và 3. D. 3 và 0.
Đáp án: B
Tổng số hạt n và p trong hạt nhân nguyên tử này là:
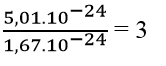
Nguyên tử có 1 electron ở lớp vỏ nguyên tử nên sẽ có 1 proton trong hạt nhân. Suy ra số hạt nowtron trong hạt nhân là 2.
Câu 7: Cho biết nguyên tử crom có khối lượng 52u, bán kính nguyên tử này bằng 1,28 Å.
a) Khối lượng riêng của nguyên tử crom là
A. 2,47 g/cm3.
B. 9,89 g/cm3.
C. 5,20 g/cm3.
D. 5,92 g/cm3.
b) Coi khối lượng của nguyên tử tập trung trong hạt nhân. Khối lượng riêng của hạt nhân nguyên tử crom là
A. 2,31.1011 kg/cm3.
B. 1,38.1014 kg/cm3.
C. 2,89.1010 kg/cm3.
D. 2,31.1013 kg/cm3.
Đáp án: a/ B; b/ D
Coi nguyên tử crom là hình cầu, thể tích nguyên tử là
V=(4/3) πr3 = 8,78. 10-24 (cm3)
Vậy khối lượng riêng của nguyên tử là
D = m/V = (52.1,67.10-24)/(8,78. 10-24 ) = 9,89 (g/cm3)
Thực tế coi nguyên tử là một quả cầu rỗng, khối lượng tập trung ở hạt nhân.
Thể tích hạt nhân là : V = 4/3 πr3= 3,76.10-39 (cm3)
Vậy khối lượng riêng của hạt nhân là :
D = m/V = (52.1,67.10-27)/(3,76.10-39 ) = 2,31.10-13 (kg/cm3)
Câu 8: Bắn một chùm tia αđâm xuyên qua một mảnh kim loại. hỏi khi một hạt nhân bị bắn phá, có khoảng bao nhiêu hạt α đã đi xuyên qua nguyên tử? biết rằng đường kính nguyên tử lớn hơn đường kính của hạt nhân khoảng 104 lần.
A. 106. B. 107. C. 108. D. 109.
Đáp án: C
Khi bắn một chùm tia α qua 1 nguyên tử : các tia sẽ đi qua tiết diện ngang của nguyên tử và hạt nhân.
Tỉ lệ giữa tiết diện ngang của nguyên tử và hạt nhân là : (πd2)/(πd'2 )
Trong đó: d là đường kính của nguyên tử và d’ là đường kính hạt nhân. Tỉ lệ này bằng (104)2 = 108.
Vậy: khi có 1 tia α gặp hạt nhân thì có 108 hạt α đã đi xuyên qua nguyên tử.
Câu 9: Trong nguyên tử, loại hạt nào có khối lượng không đáng kể so với các hạt còn lại ?
A. proton. B. nơtron.
C. electron. D. nơtron và electron
Đáp án: C
Câu 10: Một nguyên tử (X) có 13 proton trong hạt nhân. Khối lượng của proton trong hạt nhân nguyên tử X là:
A. 78,26.1023 gam. B. 21,71.10-24 gam.
C. 27 đvC. D. 27 gam
Đáp án: C
mp = 13.1,6726.10-24 = 21,71.10-24 g
Câu 11: Tổng số nguyên tử trong 0,01 mol phân tử NH4NO3 là
A. 5,418.1021 B. 5,4198.1022
C. 6,023.1022 D. 4,125.1021
Đáp án: B
Số nguyên tử của phân tử NH4NO3 = 0,01.6,022.1022.(1 + 4 + 1 + 3) = 5,4198.1022
Câu 12: Kim loại crom có cấu trúc tinh thể, với phần rỗng chiếm 32%. Khối lượng riêng của crom là d = 7,19 g/cm3. Bán kính nguyên tử của crom là: (cho biết Cr: 52g/mol).
A. 1,52 A0 B. 1,52 nm
C. 1,25nm D. 1,25A0
Đáp án: D
1 mol nguyên tử Cr chứa 6,022.1023 nguyên tử Cr
Vtinh thể = 52/7,19 = 7,23 (cm3)
Vnguyên tử Cr = 0,68.7,23/6,023.1023 = 8,16.10-24 cm3 = 4πR3/3
R = 1,25.10-8 cm = 1,25 A0
Câu 13: Biết 1 mol nguyên tử sắt có khối lượng bằng 56g, một nguyên tử sắt có 26 electron. Số hạt electron có trong 5,6g sắt là:
A. 15,66.1024 B. 15,66.1021
C. 15,66.1022 D. 15,66.1023
Đáp án: D
nFe = 0,1 mol → số nguyên tử Fe = 0,1.6,023.1023 = 6,023.1022
Số hạt p = 26.6,023.1022 = 15,66.1023
Câu 14: Hạt mang điện trong nhân nguyên tử là
A. electron. B. proton.
C. nơtron. D. nơtron và electron.
Đáp án: B
Câu 15: Trong nguyên tử, loại hạt nào có khối lượng không đáng kể so với các hạt còn lại ?
A. proton. B. nơtron.
C. electron. D. nơtron và electron.
Đáp án: C
Trắc nghiệm Hạt nhân nguyên tử. Nguyên tố hóa học. Đồng vị có đáp án năm 2023
Câu 1: Hai nguyên tử C và B có cùng
A. số proton.
B. số nơtron.
C. tính chất vật lý.
D. tính chất hóa học.
Đáp án: B
Câu 2: Có những phát biểu sau đây về các đồng vị của cùng một nguyên tố hóa học:
Các đồng vị có tính chất hóa học giống nhau.
Các đồng vị có tính chất vật lí khác nhau.
Các đồng vị có cùng số electron ở vỏ nguyên tử.
Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Đáp án: D
Câu 3: Nguyên tử của nguyên tố A có 56 electron, trong hạt nhân có 81 nơtron. Kí hiệu của nguyên tử nguyên tố A là
A. 56137A
B. 13756A
C. 5681A
D. 8156A
Đáp án: A
Câu 4: Các hạt X, Y, Z có thành phần cấu tạo như sau:
| Hạt | Số electron | Số nơtron | Số proton |
| X | 18 | 22 | 18 |
| Y | 18 | 20 | 19 |
| Z | 18 | 18 | 17 |
Phát biểu nào sau đây là đúng?
A. X và Z là các hạt của cùng một nguyên tố hóa học.
B. Các hạt Y và Z có cùng số khối.
C. X là hạt trung hòa về điện, còn Y là hạt tích điện dương.
D. Hạt Z tích điện dương.
Đáp án: C
Câu 5: Cặp nào sau đây không có sự phù hợp giữa đồng vị phóng xạ và ứng dụng thực tiễn của nó?
| Đồng vị phóng xạ | Ứng dụng | |
| A | 235U | Sản xuất điện tích hạt nhân |
| B | 60Co | Tiêu diệt tế bào ung thư |
| C | 14C | Xác định tuổi của các hóa thạch |
| D | 23Na | Phát hiện vết nứt trong đường ống |
Đáp án: D
24Na có tính phóng xạ mới được dùng để phát hiện vết nứt trong đường ống.
Câu 6: Trong tự nhiên, một nguyên tử 86222Ra tự động phân rã ra một hạt nhân nguyên tử 24He và một hạt nhân nguyên tử X. X là
A. 86222Rn
B. 86136Rn
C. 88222Ra
D. 88134Ra
Đáp án: A
Câu 7: Khi dung hạt 2048Ca bắn vào hạt nhân 95243Am thì thu được một hạt nhân siêu nặng, đồng thời có 3 nơtron bị tách ra. Cấu tạo hạt nhân nguyên tố siêu nặng này gồm
A. 176n và 115p.
B. 173n và 115p.
C. 115n và 176p.
D. 115n và 173p.
Đáp án: B
Câu 8: Trong tự nhiên, oxi có 3 đồng vị là 16O, 17O, 18O. Có bao nhiêu loại phân tử O2?
A. 3. B. 6. C. 9. D. 12.
Đáp án: B
Các loại phân tử oxi là:
16O- 16O, 16O- 17O, 16O- 18O, 17O- 17O, 17O- 18O, 18O- 18OCâu 9: Trong tự nhiên hidro chủ yếu tồn tại 2 đồng vị 11H và 12H (còn gọi là đơteri, kí hiệu là D). Nước tự nhiên tồn tại dạng nước bán nặng (HOD) và nước thường (H2O). Để tách được 1 gam nước bán nặng cần lấy bao nhiêu gam nước tự nhiên? Cho biết nguyên tử khối của oxi là 16, nguyên tử khối của hidro là 1,008.
A. 17,86 gam. B. 55,55 gam.
C. 125,05 gam. D. 118,55 gam.
Đáp án: D
Gọi x là hàm lượng % về số nguyên tử 11H, vậy hàm lượng % về số nguyên tử của 12H là (100 – x).
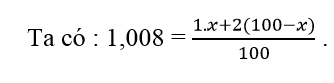
Tính ra x = 99,2%
Vậy cứ 1000 phân tử nước tự nhiên thì có 992 phân tử nước thường và 8 phân tử nước bán nặng.
Ta có MDOH = 19.
Vậy 1 gam nước bán nặng có 1/19 = 5,26.10-2 (mol).
Để tách được 5,26.10-2 mol nước bán nặng cần số mol nước tự nhiên là:
5,26. 10-2. 1000/8 = 6,58 (mol)
Mnước tự nhiên = 1,008.2 + 16 = 18,016.
Khối lượng nước cần dùng là: 6,58.18,016 = 118,55 (gam).
Câu 10: Trong tự nhiên, X có hai đồng vị 1735X và 1737X, chiếm lần lượt 75,77% và 24,23% số nguyên tử X. Y có hai đông vị à 11Y và 12Y, chiếm lần lượt 99,2% và 0,8% số nguyên tử Y.
a) Trong tự nhiên có bao nhiêu loại phân tử XY?
A. 2 B. 4 C. 5 D. 6
b) Phân tử khối trung bình của XY là
A. 36,0. B. 36,5. C. 37,5. D. 37,0.
Đáp án: B
a) Các loại phân tử XY là: 35X – 1Y, 35X – 2Y, 37X – 1Y, 37X – 2Y
b) Nguyên tử khối trung bình của X :
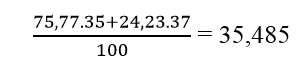
Nguyên tử khối trung bình Y là:
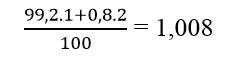
Phân tử khối trung bình của XY: 36,493 ≈ 36,5.
Câu 11: Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại X và Y là 142, trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 42. Số hạt mang điện của nguyên tử Y nhiều hơn của X là 12. Hai kim loại X, Y lần lượt là
A. Na, K. B. K, Ca.
C. Mg, Fe. D. Ca, Fe.
Đáp án: D
Ta có hệ:
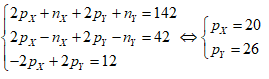
Vậy, kim loại X là Ca, Y là Fe.
Câu 12: Cho các phát biểu sau:
(1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và notron.
(2). Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3). Trong nguyên tử số electron bằng số proton.
(4). Trong hạt nhân nguyên tử hạt mang điện là proton và electron.
(5). Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1 B. 2
C. 3 D. 4
Đáp án: B
Những phát biểu đúng là: (1) và (5)
Câu 13: Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau :
| Đồng vị | 24Mg | 25Mg | 26Mg |
| % | 78,6 | 10,1 | 11,3 |
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của hai đồng vị 24Mg và 26Mg lần lượt là:
A. 389 và 56 B. 56 và 389
C. 495 và 56 D. 56 và 495
Đáp án: A
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 24Mg, thì số nguyên tử tương ứng của 2 đồng vị còn lại là :
Số nguyên tử
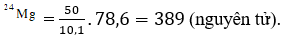
Số nguyên tử
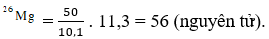
Câu 14: Biết rằng nguyên tố agon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng : 0,34% ; 0,06% và 99,6%. Số khối của đồng vị A của nguyên tố agon là? biết rằng nguyên tử khối trung bình của agon bằng 39,98.
A. 37 B. 39
C. 40 D. 41
Đáp án:
Ta có:
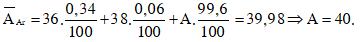
Câu 15: Mỗi phân tử XY2 có tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác định kí hiệu hoá học của X, Y lần lượt là
A. Fe và S B. S và O
C. C và O D. Pb và Cl
Đáp án: A
Kí hiệu số đơn vị điện tích hạt nhân của X là ZX , Y là ZY ; số nơtron (hạt không mang điện) của X là NX, Y là NY. Với XY2, ta có các phương trình:
tổng các hạt proton, nơtron, electron bằng 178 → 2 ZX + 4 ZY + NX + 2NY = 178 (1)
số hạt mang điện nhiều hơn số hạt không mang điện là 54 → 2 ZX + 4ZY - NX 2 NY = 54 (2)
số hạt mang điện của X ít hơn số hạt mang điện của Y là 12 → 4 ZY - 2 ZX = 12 (3)
→ ZY = 16; ZX = 26
Vậy X là sắt, Y là lưu huỳnh. XY2 là FeS2
Trắc nghiệm Luyện tập Thành phần nguyên tử có đáp án năm 2023
Câu 1: Hạt X và Y có cấu tạo như sau:
Phát biểu nào sau đây về X và Y là đúng?
A. X và Y là các đồng vị của cùng một nguyên tố hóa học.
B. X và Y là các hạt có điện tích trái dấu.
C. X và Y là các hạt mang điện tích âm.
D. X và Y là các hạt mang điện tích dương.
Đáp án: A
Hạt X và Y có cùng số proton và khác nhau về số nowtron.
Câu 2: Một nguyên tố X có 2 đồng vị là 127X và 131X.
Phát biểu nào sau đây là đúng?
A. 127X có ít hơn 131X 4 nơtron và 4 electron.
B. 127X có ít hơn 131X 4 nơtron.
C. 127X có ít hơn 131X 4 proton và 4 electron.
D. 127X có ít hơn 131X 4 proton.
Đáp án: B
Câu 3: Trong các phát biểu sau đây, phát biểu nào đúng?
A. Tôm-xơn (Thomson) đã đề xuất mô hình nguyên tử, trong đó hạt nhân chỉ chứa các hạt proton và nơtron.
B. Hạt nơtron không mang điện, nó được tạo thành bởi sự kết hợp một hạt proton và một hạt electron.
C. Khối lượng của electron bằng khoảng 1/2000 khối lượng của proton.
D. Đồng vị 131I của iot được sử dụng tron chẩn đoán và điều trị bệnh tuyến giáp.
Đáp án: D
Câu 4: Nguyên tử A có tổng số hạt mang điện và hạt không mang điện là 28, trong đó số hạt mang điện gấp 1,8 lần só hạt không mang điện. A là
A. 18Ar. B. 10Ne. C. 9F. D. 8O.
Đáp án: C
Câu 5: Trong tự nhiên tìm được hai đồng vị của nguyên tố X. Khảo sát cho thấy cứ 100 nguyên tử của X thì có 73 nguyên tử 63X. Biết rằng nguyên tử khối trung bình của X là 63,546, số khối của đồng vị còn lại là
A. 64 B. 65 C. 66 D. 67
Đáp án: B
Đặt số khối của đồng vị còn lại là x.
Theo đề bài ta có: (73.63 + 27.x)/100 = 63,546 ⇒ x = 65
Câu 6: Cho biết:
| Nguyên tố | Đồng vị | Khối lượng nguyên tử trung bình |
| Brom | 3579Br và 3581Br | 79,90 |
| Li | 36Li và 37Li | 6,94 |
Phát biểu nào sau đây là sai?
A. Hai đồng vị của Br có hàm lượng xấp xỉ bằng nhau.
B. Trong tự nhiên, liti tồn tại chủ yếu là đồng vị 37Li.
C. Có 4 loại phân tử LiBr trong tự nhiên với % phân tử xấp xỉ bằng nhau.
D. Phân tử khối của LiBr lớn nhất là 88.
Đáp án: C
Câu 7: Thực nghiệm chỉ ra rằng các nguyên tử bền có tỉ lệ số nơtron/số proton nằm trong khoảng 1 ≤ N/P ≤ 1,5 (trừ trường hợp nguyên tử H). Một nguyên tử X bền có tổng số hạt (proton, nơtron, electron) là 13. X là nguyên tử của nguyên tố nào sau đây?
A. liti B. beri C. cacbon D. nitơ
Đáp án: B
Ta có: 2p + n =13
Mặt khác: vì 1,5p ≥ n ≥ p ⇒ 4,3 ≥ p ≥ 3,7 ⇒ p = 4.
Đó là nguyên tử của nguyên tố beri.
Câu 8: Hợp chất Z được tạo bởi hai nguyên tố X và Y có công thức XY2 trong đó Y chiếm 72,73% về khối lượng. Biết rằng trong phân tử Z, tổng số hạt (proton, nơtron, electron) là 66, số proton là 22. Nguyên tố Y là
A. cacbon. B. oxi. C. lưu huỳnh. D. magie.
Đáp án: A
Gọi số hạt proton, nơtron của X là pX, nX ; số hạt proton, nơtron của Y là pY và nY.
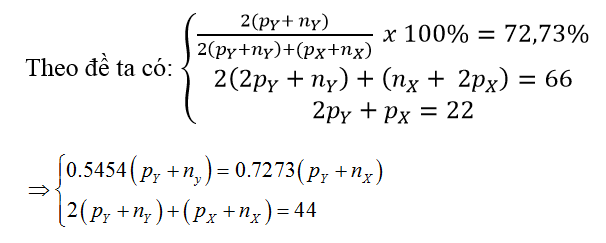
⇒ pY + nY = 16 và pX + nX = 12
Vậy: Y là oxi và X là cacbon.
Giá trị pY = nY = 8 và pX = nX = 6 thỏa mãn các phương trình.
Câu 9: Oxit X có công thức R2O. Tổng số hạt cơ bản (p, n, e) trong X là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. X là chất nào dưới đây (biết rằng trong hạt nhân nguyên tử oxi có 8 proton và 8 nơtron) ?
A. N2O. B. Na2O.
C. Cl2O. D. K2O.
Đáp án: B
Tổng số hạt cơ bản (p, n, e) trong X là 92 → 2. (2pR + nR) + 2pO + nO = 92 → 2. (2pR + nR) = 68
Số hạt mang điện nhiều hơn số hạt không mang điện là 28 → (2.2pR + 2.nO ) - (2nR + nO) = 28
→ 4pR - 2nR = 20
Giải hệ → pR = 11, nR = 12 → R là Na
Câu 10: Ở 20oC khối lượng riêng của Au là 19,32 g/cm3. Trong tinh thể Au, các nguyên tử Au là những hình cầu chiếm 75% thể tích toàn khối tinh thể, phần còn lại là các khe rỗng giữa các quả cầu. Khối lượng mol của Au là 196,97. Bán kính nguyên tử gần đúng của Au ở 20oC là:
A. 1,28.10-8 cm. B. 1,44.10-8 cm.
C. 1,59.10-8 cm D. 1,75.10-8 cm.
Đáp án: A
Giả sử trong 1 mol Fe.
Thể tích thực của Fe là:
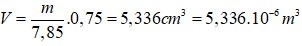
Thể tích 1 nguyên tử Fe là:
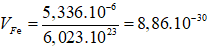
Bán kính:
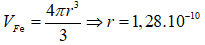
Câu 11: Tổng số proton, notron, electron trong nguyên tử của hai nguyên tố X và M lần lươt là 52 và 82. M và X tạo hơp chất MXa, trong phân tử của hơp chất đó tổng số pronton của các nguyên tử là 77. Xác định công thức của MXa. Biết trong X có tỉ lệ notron: proton ≤ 1,22.
A. FeCl3 B. AlCl3
C. FeBr3 D. AlBr3
Đáp án:
Kí hiệu số p, n, e trong nguyên tố X là Z, N, E
Theo đầu bài ta có: Z + N + E = 52 → 2Z + N = 52
Với những nguyên tố bền (trừ hidro): Z ≤ N ≤ 1,52 Z → 3Z ≤ 2Z + N ≤ 1,52Z + 2Z
→ 3Z ≤ 52 ≤ 3,52Z → 14,77 ≤ Z ≤ 17,33
Với Z = 15 → N = 22; tỉ lệ N : Z = 22 : 15 = 1,47 > 1,22 (loại)
Với Z = 16 → N = 20; tỉ lệ N : Z = 20 : 16 = 1,25 > 1,22 (loại)
Với Z = 17 → N = 18; tỉ lệ N : Z = 18 : 17 = 1,06. X là clo
Kí hiệu số p, n, e của M là Z’, N’, E’
Theo đầu bài ta có: 2Z’ + N’ = 82 → 3Z' < 82 < 3,52Z'
Ta có Z’ = 77 – 17a →
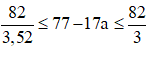
→ Z' = 77 - 17.3 = 26 → M là Fe.
Công thức thức của hợp chất là FeCl3.
Câu 12: Một loại khí clo có chứa 2 đồng vị
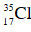
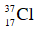
- Phần thứ nhất cho tác dụng vừa đủ với 125 ml dung dịch Ba(OH)2 0,88M.
- Phần thứ hai cho tác dụng với AgNO3 vừa đủ ta thu được 31,57 gam kết tủa.
Thành phần % số nguyên tử của đồng vị
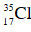
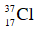
A. 75% và 25% B. 25% và 75%
C. 30% và 70% D. 70% và 30%
Đáp án: A
Gọi phần trăm số nguyên tử của
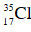
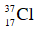
Cl2 + H2 → 2HCl (1)
Thí nghiệm 1: nBa(OH)2 = 0,88. 0,125 = 0,11 mol.
2HCl (0,22) + Ba(OH)2 (0,11 mol) → BaCl2 + 2H2O (2)
Thí nghiệm 2:
HCl + AgNO3 (0,22) → AgCl ↓ (0,22 mol) + HNO3 (3)
Vậy MAgCl = 108 + MCl = 31,57/0,22 = 143,5 → MCl = 143,5 – 108 = 35,5
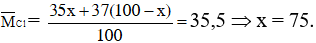
Vậy thành phần phần trăm mỗi loại đồng vị của clo là :
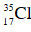
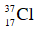
Câu 13: Nhận định nào sau đây không đúng
A. Tất cả các hạt nhân nguyên tử đều chứa proton và notron
B. Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện
C. Vỏ electron mang điện tích âm và chuyển động xung quanh hạt nhân
D. Khối lượng nguyên tử tập trung ở hạt nhân
Đáp án: A
Câu 14: Nguyên tử X có chứa 13 hạt electron và 14 hạt nơtron . Kí hiệu của nguyên tử X là :
A.
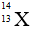
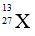
C.
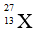
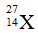
Đáp án: C
Câu 15: Cho những nguyên tử của các nguyên tố sau:
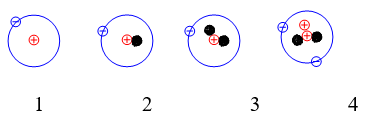
Những nguyên tử nào sau đây là đồng vị của nhau ?
A. 1 và 2 B. 2 và 3
C. 1, 2 và 3 D. Cả 1, 2, 3, 4
Đáp án: C


