Trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 2 (Bài kiểm tra số 4) có đáp án năm 2021
Trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 2 (Bài kiểm tra số 4) có đáp án năm 2021
Với bộ bài tập trắc nghiệm Đề kiểm tra 1 tiết Hóa 10 Học kì 2 (Bài kiểm tra số 4) có đáp án năm 2021 sẽ giúp học sinh hệ thống lại kiến thức bài học và ôn luyện để đạt kết quả cao trong các bài thi môn Hóa lớp 10.
Câu 1: Nguyên tố nào sau đây thuộc nhóm nguyên tố halogen?
A. O B. Cl C. N D. Si
Đáp án: B
Câu 2: Đặc điểm nào dưới đây không phải là đặc điểm chung của các nguyên tố halogen (X)?
A. Nguyên tử X có khả năng nhận thêm 1 electron.
B. X tạo hợp chất liên kết cộng hóa trị với hidro.
C. X có số oxi hóa -1 trong mọi hợp chất.
D. Lớp electron ngoài cùng của nguyên tử x có 7 electron.
Đáp án: C
Câu 3: Phát biểu nào sau đây sai?
A. Trong nhóm halogen, từ flo đến iot tính oxi hóa giảm dần.
B. Flo là nguyên tố có độ âm điện lớn nhất.
C. Ở nhiệt độ thường, I2 là chất lỏng màu tím đen.
D. Ở nhiệt độ thường, Br2 là chất lỏng màu nâu đỏ.
Đáp án: C
Câu 4: Cho phản ứng: NaX(rắn) + H2SO4 (đặc) to → NaHSO4 +HX(khí)
Các hidro halogenua (HX) nào sau đây có thể điều chế theo phản ứng trên?
A. HBr và HI
B. HCl, HBr và HI
C. HF và HCl
D. HF, HCl, HBr và HI
Đáp án: C
Câu 5: Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách oxi hóa hợp chất nào sau đây?
A. NaCl B. HCl C. MnO2 D. KMnO4
Đáp án: B
Câu 6: Cho phương trình hóa học:
aKMnO4 + bHCl → cKCl + dMnCl2 + eCl2 + fH2O
Nếu a = 2 thì b bằng
A. 16 B. 10 C. 5 D. 8
Đáp án: A
Câu 7: Để loại bỏ các khí HCl, Cl2 lẫn trong khí N2, người ta có thể sử dụng lượng dư dung dịch nào trong các dung dịch sau đây?
A. NaCl B. CuCl2 C. Ca(OH)2 D. H2SO4
Đáp án: C
Câu 8: Cho các chất sau: Na, Cu, H2, O2, dung dịch NaOH. Trong điều kiện thích hợp, số chất tác dụng được với Cl¬2 là
A. 2 B. 3 C. 4 D. 5
Đáp án: C
Câu 9: Cho các phản ứng sau:
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
2HCl + CaOCl2 → CaCl2 + Cl2 + H2O
3HCl + Fe(OH)3 → FeCl3 + 3H2O
6HCl + 2Al → 2AlCl3 + 3H2
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Trong các phản ứng trên, số phản ứng trong đó HCl thể hiện tính khử là
A. 2 B. 1 C. 4 D. 3
Đáp án: D
Câu 10: Trong phản ứng hóa học: Cl2 + 2NaOH → NaCl + NaClO + H2O,
A. Cl2 là chất khử, NaOH là chất oxi hóa.
B. Cl2 là chất oxi hóa, NaOH là chất khử.
C. Cl2 vừa là chất oxi hóa, vừa là chất khử.
D. NaOH vừa là chất oxi hóa, vừa là chất khử.
Đáp án: C
Câu 11: Cho các phản ứng:
Fe2O3 +HCl →
F2 + H2O to →
KMnO4 + HCl (đặc) →
NaCl + H2O đp có màng ngăn →
Trong các phản ứng trên, những phản ứng tạo ra đơn chất là
A. (1), (2), (3)
B. (1), (3), (4)
C. (2), (3), (4)
D. (1), (2), (4)
Đáp án: C
Câu 12: Phát biểu nào sau đây đúng?
A. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit.
B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
C. Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit.
D. Clorua vôi không phải là muối.
Đáp án: B
Câu 13: Phát biểu nào sau đây đúng?
A. Dung dịch HF được đựng trong lọ bằng thủy tinh.
B. Cl2 có tính oxi hóa mạnh, oxi hóa được H2O ở nhiệt độ thường.
C. HF là chất khí, tan nhiều trong nước tạo ra dung dịch axit mạnh.
D. HCl là chất khí, tan nhiều trong nước tạo ra dung dịch axit mạnh.
Đáp án: D
Câu 14: Dãy chất nào trong các dãy sau đây gồm các chất đều tác dụng được với dung dịch HCl ở điều kiện thường?
A. Al, CuO, Na2SO4
B. Zn, Ag, CaCO3
C. Mg, MgO, AgNO3
D. Fe, Cu(OH)2, NaNO3
Đáp án: C
Câu 15: Thực hiện các thí nghiệm sau:
Sục khí Cl2 vào dung dịch Ca(OH)2
Cho nước Br2 vào dung dịch KI
Cho KMnO4 vào dung dịch HCl đặc, nóng
Cho Na2CO3 vào dung dịch HCl
Trong các thí nghiệm trên, số thí nghiệm có phản ứng oxi hóa – khử xảy ra là
A. 1 B. 2 C. 3 D. 4
Đáp án: C
Câu 16: Cho sơ đồ chuyển hóa sau:
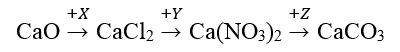
Công thức của X, Y, Z lần lượt là
A. Cl2, AgNO3, MgCO3
B. Cl2, HNO3, CO2
C. HCl, HNO3, NaNO3
D. HCl, AgNO3, (NH4)2CO3
Đáp án: D
Câu 17: Khí nào sau đây không bị oxi hóa bởi nước Gia-ven?
A. SO2 B. HCHO C. H2S D. CO2
Đáp án: D
Câu 18: Cho dung dịch chứa 12,06 gam hỗn hợp gồm NaF và NaCl phản ứng hoàn toàn với lượng dư dung dịch AgNO3 thu được 17,22 gam kết tủa. Thành phần phần trăm khối lượng của NaF trong hỗn hợp ban đầu là
A. 47,2% B. 52,8% C. 58,2% D. 41,8%
Đáp án: D
Kết tủa là AgCl.
⇒ nNaCl = nAgCl = 17,22/143,5 = 0,12 (mol)
⇒ %mNaF = (12,06 - 0,12.58,5)/12,06. 100% = 41,8%
Câu 19: Cho dung dịch chưa 14,6 gam HCl tác dụng hết với KMnO4, thu được V lít khí Cl2 (đktc). Giá trị của V là
A. 4,48 B. 8,96 C. 2,80 D. 5,60
Đáp án: C
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
nHCl = 14,6/36,5 = 0,4 (mol) ⇒ nCl2= 0,4.5/16 = 0,125 (mol)
⇒ V = 0,125.22,4 = 2,8 (lít)
Câu 20: Đốt cháy 5,95 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 20,15 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 8,96 lít B. 3,36 lít C. 4,48 lít D. 5,60 lít
Đáp án: C
Bảo toàn khối lượng:
nCl2= (20,15 - 5,95)/71 = 0,2 (mol) ⇒ V = 0,2.22,4 = 4,48 (lít)
Câu 21: Hòa tan 9,6 gam một kim loại M thuộc nhóm IIA trong dung dịch HCl (dư). Cô cạn dung dịch, thu được 38 gam muối. Kim loại X là
A. canxi B. bari C. magie D. beri
Đáp án: C
M + 2HCl → MCl2 + H2 ↑
nM = nMCl2 ⇒ 9,6/M = 38/(M + 71) ⇒ M = 24 (Mg)
Câu 22: Hòa tan hoàn toàn 16,1 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch HCl, thu được 6,72 lít hidro (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 26,15 B. 37,40 C. 14,96 D. 26,75
Đáp án: B
nH2 = 6,72/22,4 = 0,3 (mol) ⇒ nHCl = 2nH2= 0,6 (mol)
Bảo toàn khối lượng: 16,1 + 0,6.36,5 = m + 0,3.2 ⇒ m = 37,40 gam
Câu 23: Cho 3,09 gam muối natri halogenua (X) tác dụng với dung dịch AgNO3 dư thì thu được một kết tủa, kết tủa này sau khi phân hủy hoàn toàn cho 3,24 gam bạc. Công thức của muối X là
A. NaF B. NaBr C. NaI D. NaCl
Đáp án: B
NaY + AgNO3 → AgNO3 + AgY ↓
2AgY → 2Ag + Y2
nNaY = nAgY = nAg = 3,24/108 = 0,03 (mol)
0,03(23+MY) = 3,09 ⇒ MY = 80 (Br)
Câu 24: Cho m gam một đơn chất halogen (X2) tác dụng hết với magie thì thu được 9,5 gam muối. Mặt khác cho m gam X2 tác dụng hết với nhôm thì thu được 8,9 gam muối. Đơn chất halogen X2 là
A. F2 B. Cl2 C. Br2 D. I2
Đáp án: B
Bảo toàn nguyên tố X:
2nMgX2= 3nAlX3⇒ 2.9,5/(24+2X)=3.8,9/(27+31X) ⇒ X = 35,5 (Cl)
Câu 25: Cho 15,68 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 22,2 gam hỗn hợp Y gồm Mg và Al, thu được 60,2 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
A. 75,68% B. 24,32% C. 51,35% D. 48,65%
Đáp án: B
nX = 15,68/22,4 = 0,7 mol
Bảo toàn khối lượng: mCl2 + mO2 = 60,2 – 22,2 = 38 (gam).
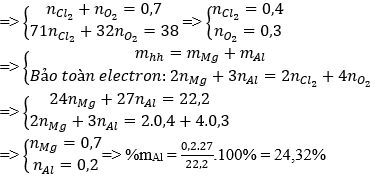
Câu 26: Hấp thụ hoàn toàn 1,12 lít khí Cl2 (đktc) vào 200 ml dung dịch NaOH (ở nhiệt độ thường). Sau phản ứng, nồng độ NaOH còn lại là 0,5M (giả thiết thể tích dung dịch không thay đổi). Nồng độ mol ban đầu của dung dịch NaOH là
A. 0,5M B. 0,1M C. 1,0M D. 2,0M
Đáp án: C
nCl2 = 1,12/22,4 = 0,05 (mol); nNaOH (dư) = 0,2.0,5 = 0,1 (mol)
Cl2 + 2NaOH → NaCl + NaClO + H2O
⇒ nNaOH(bđ) = 0,1 + 0,1 = 0,2 (mol) ⇒ CM(NaOH) = 0,2/0,2 = 1,0 (M)
Câu 27: Cho 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột tác dụng hoàn toàn với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 2M vừa đủ để phản ứng hết với Y là
A. 57 ml B. 50 ml C. 75 ml D. 90 ml
Đáp án: C
O2- + 2HCl → 2Cl- + H2O
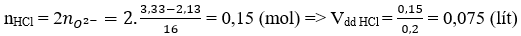
Câu 28: Khối lượng CaF2 cần dung để điều chế 400 gam dung dịch axit flohidric nồng độ 40% (hiệu suất phản ứng bằng 80%) là
A. 624 gam B. 312 gam C. 780 gam D. 390 gam
Đáp án: D
Câu 29: Để phân biệt hai lọ mất nhãn đựng dung dịch NaCl và dung dịch NaBr có thể dùng dung dịch nào trong các dung dịch sau đây?
A. AgNO3 B. HCl C. NaOH D. KNO3
Đáp án: A
Câu 30: Trong phản ứng: K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O, số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là
A. 3/7 B. 1/7 C. 3/14 D. 4/7
Đáp án: A
K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Số phân tử Cl2 là 3 ⇒ số phân tử HCl bị khử là 6.
Số phân tử HCl tham gia phản ứng là 14 ⇒ k = 6/14 = 3/7


