Trắc nghiệm Khái quát về nhóm halogen có đáp án năm 2021
Trắc nghiệm Khái quát về nhóm halogen có đáp án năm 2021
Với bộ bài tập trắc nghiệm Khái quát về nhóm halogen có đáp án năm 2021 sẽ giúp học sinh hệ thống lại kiến thức bài học và ôn luyện để đạt kết quả cao trong các bài thi môn Hóa lớp 10.
Câu 1: Những nguyên tố halogen thuộc nhóm
A. IA B. VA C. VIA D. VIIA
Đáp án: D
Câu 2: Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là
A. ns2np4 B. ns2np5 C. ns2np3 D. ns2np6
Đáp án: B
Câu 3: Nguyên tố có độ âm điện lớn nhất là
A. clo B. brom C. flo D. iot
Đáp án: C
Câu 4: Trong nhóm halogen, sự biến đổi tính chấ nào sau đây của đơn chất đi từ flo đến iot là đúng?
A. Ở điều kiện thường, trạng thái tập hợp chuyển từ thể khí sang thể lỏng và rắn.
B. Màu sắc nhạt dần.
C. Nhiệt độ nóng chảy giảm dần.
D. Tính oxi hóa tăng dần.
Đáp án: A
Câu 5: Đặc điểm chung của các đơn chất halogen (F2, Cl2, Br2, I2) :
A. ở điều kiện thường là chất khí.
B. tác dụng mãnh liệt với nước.
C. vừa cso tính oxi hóa, vừa có tính khử.
D. tính chất hóa học cơ bản là tính oxi hóa.
Đáp án: D
Câu 6: Dung dịch muối không tác dụng với dung dịch AgNO3 là
A. NaF B. NaCl C. NaBr D. NaI
Đáp án: A
Câu 7: Phát biểu nào sau đây sai?
A. Độ âm điện của brom lớn hơn độ âm điện của iot.
B. Flo có tính oxi hóa mạnh hơn clo.
C. Trong các hợp chất, flo và clo có các số oxi hóa -1, +1, +3, +5, +7.
D. Bán kính nguyên tử của clo lớn hơn bán kính nguyên tử của flo.
Đáp án: C
Câu 8: Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Thành phần phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
A. 47,2 % B. 52,8 C. 58,2% D. 41,8%
Đáp án: D
Giả sử Y không phải Flo
Gọi CTTB của X và Y là X
NaX → AgX
23 + X → 108 + X (g)
6,03 → 8,61 (g)
8,61.(23 + X) = 6,03. (108 + X)
X = 175,3 (Loại)
X là Clo, Y là Flo
Kết tủa chỉ gồm AgCl; nAgCl = nNaCl = 8,61 : 143,5 = 0,06 mol
% mNaCl = 0,06.58,5 : 6,03. 100% = 58,2% ⇒ % mNaF = 41,2%
Câu 9: Sục khí clo dư vào dung dịch chứa muối NaBr và KBr thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam. Thể tích khí clo đã tham gia phản ứng với 2 muối trên (đo ở đktc) là
A. 4,48 lít. B. 3,36 lít.
C. 2,24 lít. D. 1,12 lít.
Đáp án: D
MBr + 1/2 Cl2 → MCl + 1/2 Br2
1 mol muối giảm = 80 – 35,5 = 44,5g
⇒ nCl2 = 1/2. nmuối = 1/2 . 4,45/44,5 = 0,05 mol
⇒ VCl2 = 1,12l
Câu 10: Cho 4 đơn chất F2; Cl2; Br2; I2. Chất có nhiệt độ sôi cao nhất là :
A. F2. B. Cl2.
C. Br2. D. I2.
Đáp án: D
Câu 11: Cho các phản ứng hóa học sau, phản ứng nào chứng minh Cl2 có tính oxi hoá mạnh hơn Br2 ?
A. Br2 + 2NaCl → 2NaBr + Cl2
B. Cl2 + 2NaOH → NaCl + NaClO + H2O
C. Br2 + 2NaOH → NaBr + NaBrO + H2O
D. Cl2 + 2NaBr → 2NaCl + Br2
Đáp án: D
Câu 12: Hỗn hợp X gồm NaBr và NaI. Cho hỗn hợp X tan trong nước thu được dung dịch A. Nếu cho brom dư vào dung dịch A, sau phản ứng hoàn toàn, cô cạn thấy khối lượng muối khan thu được giảm 7,05 gam. Nếu sục khí clo dư vào dung dịch A, phản ứng hoàn toàn, cô cạn dung dịch thấy khối lượng muối khan giảm 22,625 gam. Thành phần % khối lượng của một chất trong hỗn hợp X là:
A. 64,3%. B. 39,1%.
C. 47,8%. D. 35,9%
Đáp án: C
NaBr (x mol); NaI (y mol)
Cho Br2 vào dung dịch A chỉ phản ứng với NaI
NaI + 1/2 Br2 → NaBr + 1/2 I2
1 mol NaI → 1 mol NaBr giảm 47g
⇒ nNaI = 0,15 mol = y
Khi sục khí Clo: m giảm = x.(80 – 35,5) + y (127-35,5) = 22,625g
⇒ x = 0,2 mol
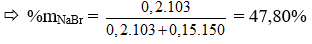
Câu 13: Hãy chỉ ra mệnh đề không chính xác:
A. Tất cả muối AgX (X là halogen) đều không tan trong nước.
B. Tất cả các hiđro halogenua đều tồn tại ở thể khí, ở điều kiện thường.
C. Tất cả các hiđro halogenua khi tan vào nước đều cho dung dịch axit.
D. Các halogen (từ F2 đến I2) tác dụng trực tiếp với hầu hết các kim loại.
Đáp án: A
Câu 14: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 8,96 lít. B. 6,72 lít.
C. 17,92 lít. D. 11,2 lít.
Đáp án: A
Bảo toàn khối lượng: mCl2 = mmuối – mkim loại = 28,4g
⇒ VCl2 = (28,4:71). 22,4 = 8,96l
Câu 15: Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron ?
A. Nhận thêm 1 electron.
B. Nhận thêm 2 electron.
C. Nhường đi 1 electron.
D. Nhường đi 7 electron.
Đáp án: A


