Bài 38.12, 38.13, 38.14, 38.15, 38.16, 38.17, 38.18, 38.19 trang 54 SBT Hóa học 8
Bài 38.12, 38.13, 38.14, 38.15, 38.16, 38.17, 38.18, 38.19 trang 54 SBT Hóa học 8
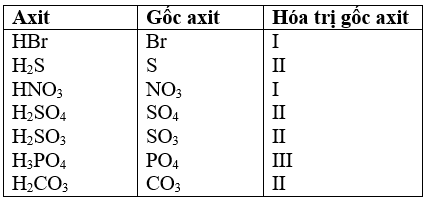
Bài 38.12 trang 54 sách bài tập Hóa 8: Thế nào là gốc axit? Tính hóa trị của các gốc axit tương ứng với axit sau:
HBr, H2S, HNO3, H2SO4, H2SO3, H3PO4, H2CO3
Lời giải:
Gốc axit là phần còn lại của phân tử axit sau khi tách riêng nguyên tử hidro trong phân tử axit.
Bài 38.13 trang 54 sách bài tập Hóa 8: a) Xác định hóa trị của Ca, Na,Fe, Cu,Al trong các hidroxit sau đây:
Ca(OH)2, NaOH, Fe(OH)3, Cu(OH)2, Al(OH)3
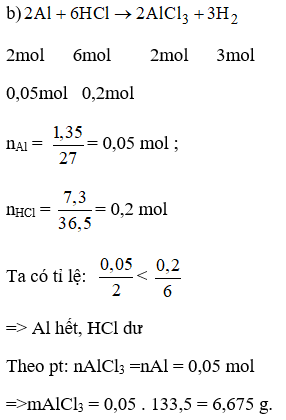
b) Trong 1,35g nhôm tác dụng với dung dịch chứa 7,3g HCl. Khối lượng muối tạo thành là:
A. 3,3375g B. 6,675g. C. 7,775g D. 10,775g
Hãy chọn đáp án đúng.
Lời giải:
a) Ca(OH)2: Ca có hóa trị II;
Cu(OH)2 : Cu có hóa trị II;
NaOH: Na có hóa trị I;
Al(OH)3: Al có hóa trị III;
Fe(OH)3: Fe có hóa trị III.
→ Chọn B.
Bài 38.14 trang 54 sách bài tập Hóa 8: Hãy nêu phương pháp nhận biết các khí: cacbon dioxit, oxi, nito, hidro.
Lời giải:
- Lấy từng mẫu thử ở mỗi khí. Đưa đầu que đóm có than hồng và từng mẫu thử. Mẫu thử nào làm than hồng bùng cháy đó chính là oxi.
- Đưa que đóm đang cháy vào các khí còn lại, khí nào làm cháy được với ngọn lửa màu xanh, đó là H2.
- Cho các khí còn lại qua nước vôi trong. Khí nào làm đục nước vôi trong đó là CO2. Còn lại là khí nito không làm đục nước vôi trong.
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
Bài 38.15 trang 54 sách bài tập Hóa 8: Cho 60,5g hỗn hợp gồm 2 kim loại kẽm Zn và sắt Fe tác dụng hêt với dung dịch axit clohidric. Thành phần phần trăm khối lượng của sắt trong hỗn hợp là 46,289%. Tính:
a) Khối lượng mỗi kim loại trong hỗn hợp.
b) Thể tích khí H2 (đktc) sinh ra.
c) Khối lượng các muối tạo thành.
Lời giải:
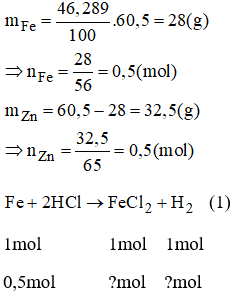

Bài 38.16 trang 54 sách bài tập Hóa 8: Cho 22,4g sắt tác dụng với dung dịch loãng có chứa 24,5g axit H2SO4.
a) Tính thể tích khí H2 thu được ở đktc.
b) Chất nào thừa sau phản ứng và thừa bao nhiêu gì?
Lời giải:
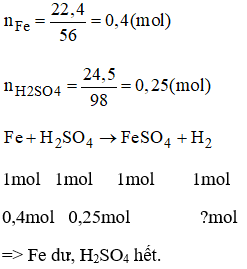
a) Theo pt nH2 = nH2SO4 = 0,25 mol ⇒ VH2 = 0,25 .22,4 = 5,6 l
b) Sắt thừa sau phản ứng:
Theo pt nFe(pư) = nH2SO4 = 0,25 mol ⇒ mFe (pư) = 0,25 .56 = 14g
mFe (dư) = 22,4 - 14 = 8,4 g
Bài 38.17 trang 54 sách bài tập Hóa 8: Dẫn 6,72 lit (ở đktc) hỗn hợp hai khí H2 và CO từ từ qua hỗn hợp hai oxit FeO và CuO nung nóng, sau phản ứng thấy khối lượng hỗn hợp giảm m gam.
a) Viết phương trình hóa học
b) Tính m
c) Tính phần trăm thể tích các khí, biết tỉ khối các khí so với CH4 bằng 0,45.
Lời giải:
a) Các PTHH:
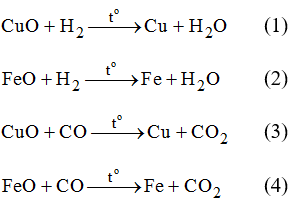
b) Khối lượng chất rắn giảm đi sau phản ứng do đã mất bớt các nguyên tử oxi trong oxit để tạo thành kim loại.
Từ phương trình hóa học ở câu a, ta có số mol nguyên tử của oxi trong oxit mất đi bằng với số mol của CO và H2 tham gia phản ứng
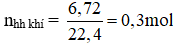
Vậy khối lượng chất rắn giảm đi: 0,3 . 16 = 4,8g
c) Gọi x là số mol của H2
y là số mol của CO
Theo đề bài, ta có:
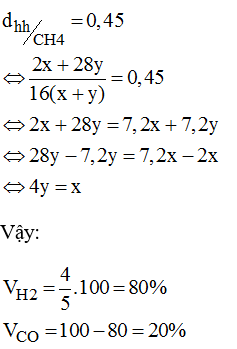
Bài 38.18 trang 54 sách bài tập Hóa 8: Cho 3,6g một oxit sắt vào dung dịch HCl dư. Sauk hi phản ứng xảy ra hoàn toàn thu được 6,35g một muối sắt clorua. Hãy xác định công thức phân tử của oxit sắt.
Lời giải:
Gọi công thức oxit sắt là Fe2Ox
PTHH:
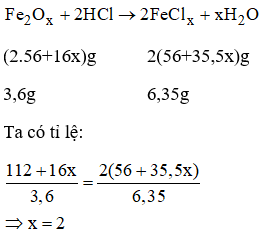
Công thức oxit sắt là FeO
Bài 38.19 trang 54 sách bài tập Hóa 8: Cho dòng khí H2 dư qua 24g hỗn hợp hai oxit CuO và Fe2O3 nung nóng. Tính khối lượng Fe và Cu thu được sau phản ứng. Biết rằng: mFe2O3 : mCuO = 3 : 1
Lời giải:
Theo đề bài, ta có:

Theo pt: nFe = 2.nFe2O3 = 2. 0,1125 = 0,225 mol
nCu = nCuO = 0,075 mol
mFe = 0,225.56 = 12,6(g)
mCu = 0,075.64 = 4,8(g)

