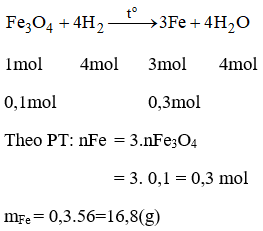Bài 38.20, 38.21, 38.22, 38.23, 38.24 trang 55 SBT Hóa học 8
Bài 38.20, 38.21, 38.22, 38.23, 38.24 trang 55 SBT Hóa học 8
Bài 38.20 trang 55 sách bài tập Hóa 8: Cho 10,4g oxit của một nguyên tố kim loại có hóa trị II tác dụng với dung dịch HCl dư, sau phản ứng tạo thành 15,9g muối. Xác định nguyên tố kim loại.
Lời giải:
Gọi nguyên tố kim loại là A → nguyên tử khối là MA
Phương trình hóa học:
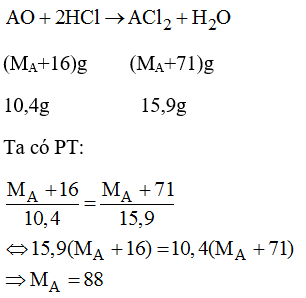
→ A là stronti (Sr)
Bài 38.21 trang 55 sách bài tập Hóa 8: Cho 0,3g một kim loại tác dụng hết nước cho 168ml khí hidro ( ở đktc). Xác định tên kim loại, biêt rằng kim loại có hóa trị tối đa là III.
Lời giải:
Gọi R là kí hiệu của kim loại có hóa trị n

Với n = 1 → MR = 20 không có kim loại nào có nguyên tử khối là 20
n = 2 → MR = 40 (Canxi)
n = 3 → MR = 60 ( loại)
Vậy R là Canxi(Ca)
Bài 38.22 trang 55 sách bài tập Hóa 8: Cho 5,6g kim loại tác dụng vừa đủ với dung dịch HCl cho 11,1 muối clorua của kim loại đó. Xác định tên kim loại. Biết kim loại có hóa trị tối đa là III.
Lời giải:
Gọi R là kí hiệu của nguyên tố kim loại có hóa trị x
Công thức phân tử của oxit kim loại là R2Ox
Phương trình hóa học
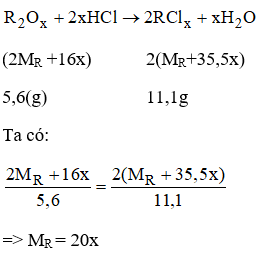
Với x = 1 → R = 20 (loại)
x = 2 → R = 40(canxi)
x = 3 → R = 60(loại)
Vậy R là canxi (Ca)
Bài 38.23 trang 55 sách bài tập Hóa 8: Cho một dòng khí H2 dư qua 4,8g hỗn hợp CuO và một oxit sắt nung nóng thu được 3,52g chất rắn. Nếu cho chất rắn đó là hòa tan trong axit HCl thì thu được 0,896lit H2 (đktc). Xác định khối lượng mỗi oxit trong hỗn hợp và công thức phân tử của oxit sắt.
Lời giải:
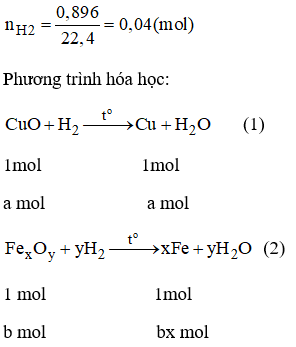
Gọi a là số mol của CuO
b là số mol của FexOy
Cho hỗn hợp chất rắn vào dung dịch HCl có H2 bay ra, chỉ có Fe tác dụng với HCl
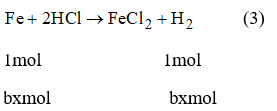
Từ PT (2) nFe = x. nFexOy = b.x mol
Từ PT (3) nH2 = nFe = b.x mol ⇒ bx = 0,04 mol
⇒ nFe = 0,04 mol
mFe = 0,04.56 = 2,24(g)
mCu = 3,52 – 2,24 = 1,28(g)
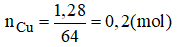
nCuO = 0,02(mol)
→ mCuO = 0,02.80=1,6(g)
mFexOy = 4,8 – 1,6 = 3,2(g)
mO trong oxit sắt = mFexOy - mFe = 3,2 - 2,24 = 0,96(g)
Trong công thức FexOy, ta có tỉ lệ:
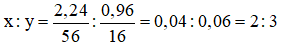
Vậy công thức phân tử của oxit sắt là Fe2O3.
Bài 38.24 trang 55 sách bài tập Hóa 8: Dùng khí H2 khử 31,2g hỗn hợp CuO và Fe3O4 trong hỗn hợp khối lượng Fe3O4 nhiều hơn khối lượng CuO là 15,2g. Tính khối lượng Cu và Fe thu được.
Lời giải:
Gọi a là khối lượng của CuO ⇒ mFe3O4 = a + 15,2
Theo đề bài, ta có: a + a + 15,2 = 31,2
2a = 16
→ a = 8
Vậy: