Bài 38.3, 38.4, 38.5, 38.6, 38.7, 38.8, 38.9, 38.10, 38.11 trang 53 SBT Hóa học 8
Bài 38.3, 38.4, 38.5, 38.6, 38.7, 38.8, 38.9, 38.10, 38.11 trang 53 SBT Hóa học 8
Bài 38.3 trang 53 sách bài tập Hóa 8: Từ những hóa chất cho sẵn KMnO4, Fe, dung dịch CuSO4, dung dịch H2SO4 loãng, hãy viết các phương trình hóa học để điều chế các chất theo sơ đồ chuyển hóa sau: Cu → CuO → Cu. Biết Fe có thể phản ứng với CuSO4 theo phương trình: Fe + CuSO4 → Cu + FeSO4
Lời giải:
Cu → CuO → Cu
Các chất cần cho biến đổi hóa học này là Cu, O2 và H2.
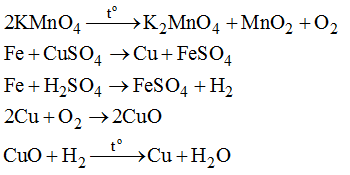
Bài 38.4 trang 53 sách bài tập Hóa 8: Khi điện phân nước thu được 2 thể tích H2 và 1 thể tích khí O2 (cùng điều kiện nhiệt độ, áp suất). Từ kết quả này, em hãy chứng minh công thức hóa học của nước.
Lời giải:
Phương trình điện phân H2O
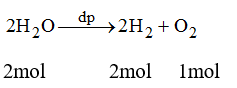
Trong cùng điều kiện nhiệt độ và áp suất tỉ lệ thể tích bằng tỉ lệ số mol, nên:
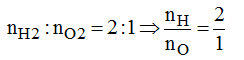
Vậy công thức hóa học của nước là H2O.
Bài 38.5 trang 53 sách bài tập Hóa 8: Để đốt cháy 68g hỗn hợp khí hidro và khí CO cần 89,6 lit oxi ( ở đktc). Xác định thành phần phần trăm của hỗn hợp ban đầu. Nêu các phương pháp giải bài toán.
Lời giải:
* Phương pháp 1:
Phương trình phản ứng:
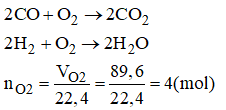
Theo phương trình phản ứng ta có:
Cứ 2mol H2 (hay CO) đều phản ứng với 1 mol oxi
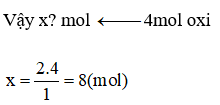
Vậy 8 mol hỗn hợp phản ứnng với 4 mol oxi.
Gọi a là số mol ở H2
→ Số mol của CO: 8 – a
Ta có:
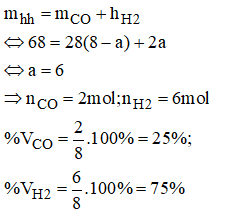
Lưu ý: Tỉ lệ số mol cũng chính bằng tỉ lệ thể tích
* Phương pháp 2:
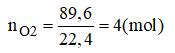
Gọi x là số mol của CO
y là số mol của H2
Theo đề bài: 28x + 2y = 68 (1)
Phương trình phản ứng:
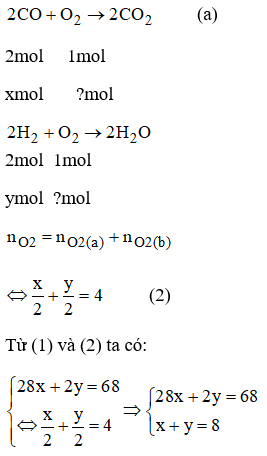
Giải hệ phương trình trên ta có: x = 2; y = 6
Sau đó tính %VCO = 25%; %VH2 = 75%
Bài 38.6 trang 53 sách bài tập Hóa 8: Khử 50g hợp đồng (II) oxit và sắt (II) oxit bằng khí hidro. Tính thể tích khí hidro cần dùng, biết rằng trong hỗn hợp, đồng (II) oxit chiếm 20% về số lượng. Các phản ứng đó thuộc loại phản ứng gì?
Lời giải:
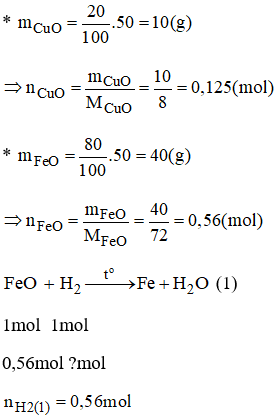
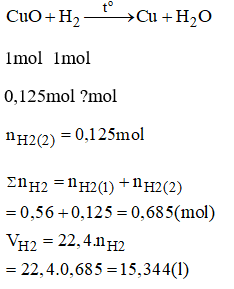
Hai phản ứng trên đều là phản ứng oxi hóa khử.
Bài 38.7 trang 53 sách bài tập Hóa 8: Khi cho 0,2 mol kẽm tác dụng với dung dịch có chứa 49g axit sunfuric
a) Viết phương trình phản ứng.
b) Sau phản ứng chất nào còn dư?
c) Tính thể tích khí hidro thu được (đktc).
Lời giải:
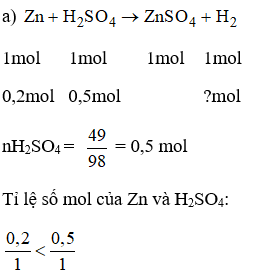
Vậy sau phản ứng H2SO4 dư; Zn hết
c) Theo pt nH2 = nZn = 0,2 mol ⇒ VH2 = 0,2. 22,4 = 4,48 l
Bài 38.8 trang 53 sách bài tập Hóa 8: Trong phòng thí nghiệm có các kim loại Al, Fe va dung dịch HCl.
a) Cho dùng một khối lượng các kim loại trên tác dụng hết với dung dịch HCl thì kim loại nào cho khí hidro nhiều hơn?
b) Nếu thu được cùng 1 lượng khí hidro thì khối lượng kim loại nào dùng ít hơn?
Lời giải:
Gọi a(g) là khối lượng của các kim loại cùng tác dụng với HCl.
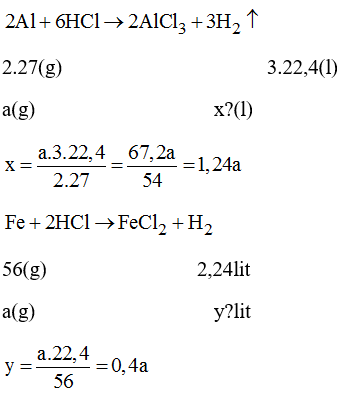
Vậy x > y hay cho cùng một lượng Al và Fe tác dụng hết dung dịch HCl thì Al cho thể tích H2 nhiều hơn sắt.
b) Nếu thu được cùng một lượng khí hidro thì lượng Al dùng ít hơn Fe.
Bài 38.9 trang 53 sách bài tập Hóa 8: Dùng khí H2 để khử hết 50g hỗn hợp A gồm đồng (II) oxit và sắt (III) oxit. Biết trong hỗn hợp sắt (III) oxit chiếm 80% khối lượng. Thể tích khí H2 cần dùng là:
A.29,4 lit B. 9,7 lit C. 19,6 lit D. 39,2 lit
Tìm câu trả lời đúng.
Lời giải:
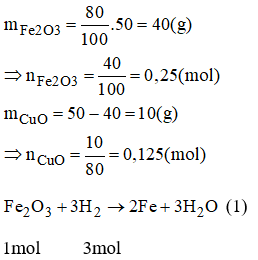
Theo pt (1) nH2 (1) = 3.nFe2O3 = 0,25.3 = 0,75(mol)
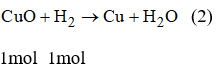
Theo pt (2): nH2 (2) = nCu = 0,125 mol
VH2 = 22,4 . nH2 = 22,4 . (nH2 (1) + nH2 (2)) = 22,4 . (0,75 + 0,125) = 19,6 (l)
⇒ Chọn C.
Bài 38.10 trang 53 sách bài tập Hóa 8: Viết công thức hóa học các muối sau đây:
a) Canxi clorua; b) Kali clorua; c) Bạc nitrat
d) Kali sunfat; e) Magie nitrat ; f) Canxi sunfat.
Lời giải:
a) CaCl2 b) KCl c) AgNO3
d) K2SO4 d) Mg(NO3)2 e) CaSO4
Bài 38.11 trang 53 sách bài tập Hóa 8: a) Cho 13g kẽm tác dụng với 0,3 mol HCl. Khối lượng muốn ZnCl2 được tạo thành trong phản ứng này là:
A. 20,4g; B. 10,2g C. 30,6g; D. 40g
Hãy chọn đáp số đúng.
b) Có thể nói trong HCl có các đơn chất hidro và Clo được không? Tại sao?
Lời giải:

b) Không thể nói trong HCl có các đơn chất hidro và clo. Vì hợp chất là những chất được tạo nên từ 2 nguyên tố hóa học trở lên do đó chỉ có thể nói HCl được tạo thành từ 2 nguyên tố hóa học là hidro và clo.

