Bài 26.6, 26.7, 26.8, 26.9, 26.10, 26.11, 26.12, 26.13, 26.14 trang 32 SBT Hóa học 9
Bài 26.6, 26.7, 26.8, 26.9, 26.10, 26.11, 26.12, 26.13, 26.14 trang 32 SBT Hóa học 9
Bài 26.6 trang 32 Sách bài tập Hóa học 9: Có 4 cốc đựng 4 chất lỏng sau : H20, dung dịch NaCl, dung dịch HCl, dung dịch Na2CO3. Không dùng hoá chất nào khác, hãy nhận biết từng chất (được dùng phương pháp vật lí).
Lời giải:
- Lấy mỗi dung dịch một ít, sau đó đổ vào nhau từng cặp một, cặp nào thấy bọt khí nổi lên thì cặp đó là HCl và Na2CO3, còn cặp kia là H2O và NaCl.
2HCl + Na2CO3 → 2NaCl + H20 + CO2
- Như vậy có hai nhóm : nhóm 1 gồm H2O và dung dịch NaCl, nhóm 2 gồm dung dịch Na2CO3 và dung dịch HCl.
- Đun đến cạn 2 cốc nhóm 1 : cốc không có cặn là H2O, cốc có cặn là muối NaCl.
- Đun đến cạn 2 cốc nhóm 2 : cốc không có cặn là HCl, cốc có cặn là muối Na2CO3.
Bài 26.7 trang 32 Sách bài tập Hóa học 9: Hợp chất nào sau đây phản ứng được với clo ?
A. NaCl ; B. NaOH ; C. CaCO3 ; D. HCl.
Lời giải:
Đáp án B.
Cl2 + 2NaOH → NaCl + NaClO + H20
Bài 26.8 trang 32 Sách bài tập Hóa học 9: Cho một luồng khí clo dư tác dụng với 9,2 gam kim loại sinh ra 23,4 gam muối của kim loại có hoá trị I. Hãy xác định tên của kim loại.
Lời giải:
- Gọi kí hiệu và nguyên tử khối của kim loại là M.
Phương trình hoá học :
2M + Cl2 → 2MCl
9,2 x 2(M + 35,5) = 2M x 23,4
653,2 = 28,4M
M = 23. Vậy kim loại M là kim loại natri (Na).
Bài 26.9 trang 32 Sách bài tập Hóa học 9: Cho 5,6 gam bột sắt vào bình khí clo có dư. Sau phản ứng thu được 16,25 gam muối sắt. Tính khối lượng khí clo đã tham gia phản ứng.
Lời giải:
Phương trình hoá học : 2Fe + 3Cl2 to FeCl3
Theo định luật bảo toàn khối lượng :
mFe + mCl2 = mFeCl3
mCl2 = mFeCl3 - mFe = 16,25 - 5,6 = 10,65g
Bài 26.10 trang 32 Sách bài tập Hóa học 9: Cho 12,7 gam muối sắt clorua vào dung dịch NaOH có dư trong bình kín, thu được 9 gam một chất kết tủa. Công thức hoá học của muối là
A. FeCl3 ; B. FeCl2 ; C. FeCl; D. Fe)4
Lời giải:
Đáp án B.
Gọi công thức của muối là FeClx(x là hóa trị của kim loại Fe).
Phương trình hóa học:
FeClx + xNaOH → Fe(OH)x + xNaCl
(56+35,5x)gam (56+17x)gam
12,7 gam 9 gam
Ta có tỷ lệ:
(56+35,5x)/12,7 = (56+17x)/9 => x = 2 → Công thức của muối là FeCl2
Bài 26.11 trang 32 Sách bài tập Hóa học 9: Viết các phương trình hoá học của các phản ứng sau (ghi rõ điều kiện phản ứng, nếu có) :
Cl2 + A → B
B + Fe → C + H2
C + E → F + NaCl
F + B → C + H2O
Lời giải:
Cl2 + H2 → 2HCl
2HCl + Fe → FeCl2 + H2
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Fe(OH)2 + HCl → FeCl2 + 2HCl
Bài 26.12 trang 32 Sách bài tập Hóa học 9: Qua hình vẽ 3.2, em hãy cho biết mức độ phản ứng giữa clo và hiđro.
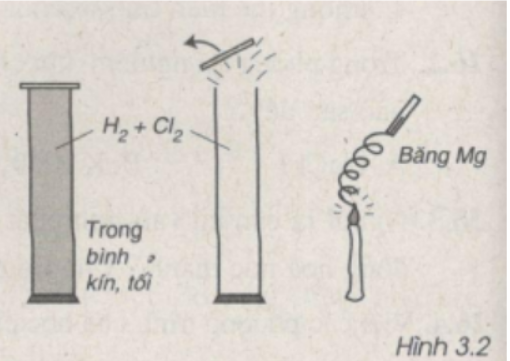
Lời giải:
Qua hình vẽ ta nhận thấy khi có ánh sáng (băng Mg cháy), Cl2 phản ứng rất mạnh với H2 nên nắp bình bị bật ra.
Bài 26.13 trang 32 Sách bài tập Hóa học 9: Trong phòng thí nghiệm có các hoá chất sau :
Dung dịch HCl, KMnO4, MnO2, NaCl, H20.
Để điều chế clo, em có thể dùng những hoá chất nào ? Viết các phương trình hoá học.
Lời giải:
4HCl + MnO2 → H2 + 2H2O + MnH2
16HCl + 2KMnO4 → 5H2 + 2MnH2 + 2KCl + 8H2O
2NaCl + 2H2O → 2NaOH + H2 + H2
Bài 26.14 trang 32 Sách bài tập Hóa học 9: Viết phương trình hoá học của các phản ứng sau (ghi rõ điều kiện phản ứng, nếu có) :
H2 + A → B
B + MnO2 → A + C + D
A + C → B + E
Lời giải:
H2 + Cl2 → 2HCl
4HCl + MnO2 → Cl2 + 2H2O + MnCl2
Cl2 + H2O → HCl + HClO

