Giáo án Hóa học 12 Bài 32: Hợp chất của sắt mới nhất
Giáo án Hóa học 12 Bài 32: Hợp chất của sắt mới nhất
Haylamdo biên soạn và sưu tầm Với mục đích giúp các Thầy / Cô giảng dạy môn Hóa học dễ dàng biên soạn Giáo án Hóa học lớp 12, VietJack biên soạn Giáo án Hóa học 12 Bài 32: Hợp chất của sắt phương pháp mới theo hướng phát triển năng lực theo 5 bước bám sát mẫu Giáo án môn Hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu Giáo án Hóa học 12 này sẽ được Thầy/Cô đón nhận và đóng góp những ý kiến quí báu.
A. CHUẨN KIẾN THỨC – KĨ NĂNG
I. KIẾN THỨC – KĨ NĂNG
1. Kiến thức
Sau khi học xong chủ đề, học sinh trình bày được:
+ Tính chất vật lí, nguyên tắc điều chế và ứng dụng của một số hợp chất của sắt (II).
Học sinh giải thích được:
+ Tính khử của hợp chất sắt (II): FeO, Fe(OH)2, muối sắt(II).
2. Kĩ năng
+ Có những kỹ năng cần thiết như dự đoán, kiểm tra bằng thí nghiệm và kết luận được tính chất hoá học của hợp chất của sắt; Làm việc nhóm, thuyết trình thông tin, phản biện.
+ Viết các phương trình hoá học minh hoạ tính khử và tính oxi hóa của Fe2+
+ Tính thành phần phần trăm về khối lượng sắt, muối sắt hoặc oxit sắt trong hỗn hợp phản ứng. Xác định tên kim loại dựa vào số liệu thực nghiệm.
+ Nhận biết được ion Fe2+ trong dung dịch.
3. Thái độ
+ Học sinh có thái độ tích cực, chủ động, nghiêm túc trong học tập, trong nghiên cứu, trong hoạt động nhóm.
+ Có ý thức bảo vệ môi trường, sử dụng hợp lí nguồn tài nguyên, các loại vật liệu bằng sắt, có ý thức tìm tòi sáng tạo tận dung những nguyên liệu có sẵn.
II. PHÁT TRIỂN NĂNG LỰC
Năng lực chuyên biệt
- Năng lực thực hành hóa học: làm thí nghiệm, quan sát hiện tượng giải thích được các hiện tượng xảy ra khi tiến hành thí nghiệm về tính chất hóa học của sắt
- Năng lực tính toán qua việc giải thích các bài tập hóa học có bối cảnh thực tiễn.
Các năng lực khác
- Năng lực sáng tạo, năng lực tư duy, năng lực giải quyết vấn đề, năng lực hợp tác trong hoạt động nhóm.
- Năng lực sử dụng ngôn ngữ: diễn đạt trình bày ý kiến nhận định của bản thân.
B. CHUẨN BỊ
3. Giáo viên
Đồ dùng dạy học:
- Dụng cụ, hóa chất: dây sắt, đinh sắt, dd H2SO4 loãng, HNO3, dd CuSO4, dd HCl, dd NaOH.
- Dụng cụ: Bộ thí nghiệm: ống nghiệm, giá sắt, đèn cồn.
- Giáo án, phiếu học tập, bảng biểu.
- Máy chiếu, Laptop.
4. Học sinh
- Chuẩn bị bài trước ở nhà theo hướng dẫn của giáo viên.
- Tích cực, chủ động thực hiện các nhiệm vụ theo lựa chọn và sự phân công.
C. PHƯƠNG PHÁP VÀ KĨ THUẬT DẠY HỌC:
Phương pháp sử dụng: Phương pháp dạy học theo nhóm, kĩ thuật khăn trải bàn
D. TIẾN TRÌNH BÀI DẠY
1. Hoạt động khởi động
1.1. Ổn định lớp: Kiểm tra sĩ số, đồng phục...
1.2. Kiểm tra bài cũ:
Giáo viên nêu vấn đề yêu cầu học sinh dùng kiến thức đã học viết các phương trình
(1) FeO + HCl →
(2) Fe(OH)2 + HCl →
(3) Fe(OH)2 + O2 + H2O →
Giáo viên gợi ý học sinh trả lời phản ứng (1), (2) hợp chất sắt (II) thể hiện tính bazơ
Sau đó nêu vấn đề ở phản ứng (3) là một tính chất đặc trưng của hợp chất sắt (II) là tính gì ?
2. Hoạt động hình thành kiến thức mới
Hoạt động của giáo viên |
Hoạt động của Học sinh – Phát triển năng lực |
Nội dung |
|
GV: Sắt có những trạng thái số oxi hóa nào? Từ đó suy ra hợp chất sắt (II) thể hiện tính chất hóa học như thế nào? GV: khẳng định hợp chất sắt (II) vừa có tính oxi hóa vừa có tính khử, nhưng ở đây đặc biệt quan tâm tới tính khử. Đó là tính chất hóa học đặc trưng của hợp chất sắt (II) GV để tìm hiểu các hợp chất của sắt (II)lớp chia thành 3 nhóm hoàn thành các nhiệm vụ sau: + NV 1: tìm hiểu FeO - Tính chất vật lý - Tính chất hóa học - Điều chế |
HS trả lời |
I. HỢP CHẤT Fe(II) - Tính chất hóa học đặc trưng của Fe(II) là tính khử (nhường 1e) Fe2+ → Fe3+ + 1e 1/. Sắt (II) oxít: FeO TCVL - FeO chất rắn, đen, không có trong tự nhiên TCHH - oxit bazơ + không tác dụng với nước + Tác dụng vơi dd axit mạnh HCl, H2SO4 loãng FeO + 2HCl → FeCl2 + H2O - Tính khử FeO tan trong dd HNO3 loãng → NO↑ 3FeO + 10HNO3(l) → 3Fe(NO3)3 + NO + 5H2O Phương trình ion thu gọn: 3FeO + NO3- + 10H+ → 3Fe3+ + NO + 5H2O - Tính oxi hóa FeO + CO → Fe + CO2 Điều chế: Fe2O3 + |
..........................................
Tài liệu còn nhiều, mời bạn tải xuống để xem đầy đủ!

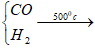 2FeO + CO2
2FeO + CO2