Giáo án Hóa học 12 Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt mới nhất
Giáo án Hóa học 12 Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt mới nhất
Haylamdo biên soạn và sưu tầm Với mục đích giúp các Thầy / Cô giảng dạy môn Hóa học dễ dàng biên soạn Giáo án Hóa học lớp 12, VietJack biên soạn Giáo án Hóa học 12 Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt phương pháp mới theo hướng phát triển năng lực theo 5 bước bám sát mẫu Giáo án môn Hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu Giáo án Hóa học 12 này sẽ được Thầy/Cô đón nhận và đóng góp những ý kiến quí báu.
A. CHUẨN KIẾN THỨC – KĨ NĂNG
I. KIẾN THỨC – KĨ NĂNG
1. Kiến thức
Củng cố hệ thống hoá kiến thức về sắt và hợp chất của sắt
2. Kĩ năng
Giải các bài tập về sắt và hợp chất của sắt.
3. Thái độ
Chuẩn bị bài trước khi đến lớp, học tập nghiêm túc
II. PHÁT TRIỂN NĂNG LỰC
* Năng lực:
1. Năng lực hợp tác
2. Năng lực giao tiếp
3. Năng lực sử dung ngôn ngữ
4. Năng lực tính toán
B. CHUẨN BỊ
7. Giáo viên
- Phiếu học tập
8. Học sinh
- Chuẩn bị bài trước ở nhà theo hướng dẫn của giáo viên.
- Tích cực, chủ động thực hiện các nhiệm vụ theo lựa chọn và sự phân công.
C. PHƯƠNG PHÁP VÀ KĨ THUẬT DẠY HỌC:
Phương pháp sử dụng: Phương pháp dạy học theo nhóm, kĩ thuật khăn trải bàn
D. TIẾN TRÌNH BÀI DẠY
1. Hoạt động khởi động
1.1. Ổn định lớp: Kiểm tra sĩ số, đồng phục...
1.2. Kiểm tra bài cũ:
2. Hoạt động hình thành kiến thức mới
Hoạt động của giáo viên |
Hoạt động của Học sinh – Phát triển năng lực |
Nội dung |
Hoạt động 1: Kiến thức cần nắm vững |
||
Gv phát vấn học sinh về nội dung kiến thức đã học |
HS: ôn lại kiến thức cũ và trả lời Phát triển năng lực giao tiếp |
I. Kiến thức cần nắm vững: (SGK) |
Hoạt động 2: Luyện tập và vận dụng |
||
|
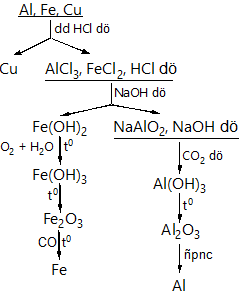
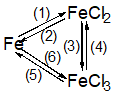
Gv phát phiếu học tập yêu cầu hs thảo luận theo nhóm Bài 1: Hoàn thành các PTHH của phản ứng theo sơ đồ sau: Bài 2: Điền CTHH của các chất vào những chổ trống và lập các PTHH sau: a) Fe + H2SO4 (đặc) → SO2↑ + … b) Fe + HNO3 (đặc) → NO2↑ + … c) Fe + HNO3 (loãng) → NO↑ + … Bài 3: Bằng phương pháp hoá học, hãy phân biệt 3 mẫu hợp kim sau: Al – Fe, Al – Cu và Cu – Fe. Bài 4: Một hỗn hợp bột gồm Al, Fe, Cu. Hãy trình bày phương pháp hoá học để tách riêng từng kim loại từ hỗn hợp đó. Viết PTHH của các phản ứng. Bài 5: Cho một ít bột Fe nguyên chất tác dụng với dung dịch H2SO4 loãng thu được 560 ml một chất khí (đkc). Nếu cho một lượng gấp đôi bột sắt nói trên tác dụng hết với dung dịch CuSO4 dư thì thu được một chất rắn. Tính khối lượng của sắt đã dùng trong hai trường hợp trên và khối lượng chất rắn thu được. |
Hs: thảo luận nhóm hoàn thành bài tập trong phiếu (Mỗi học sinh 1 phiếu) Hs: đại diện lên bảng trình bày, hs nhóm khác nhận xét, bổ sung Phát triển năng lực hợp tác, năng lực giao tiếp Phát triển năng lực tính toán |
Bài 1: Giải (1) Fe + 2HCl → FeCl2 + H2 (2) FeCl2 + Mg → MgCl2 + Fe (3) 2FeCl2 + Cl2 → 2FeCl3 (4) 2FeCl3 + Fe → 3FeCl2 (5) 2FeCl3 + 3Mg → 3MgCl2 + 2Fe (6) 2Fe + 3Cl2 → 2FeCl3 Bài 2: Giải a) 2Fe + 6H2SO4 (đặc) → Fe2(SO4)3 + 3SO2↑ + 6H2O b) Fe + 6HNO3 → Fe(NO3)3 + 3NO2↑ + 3H2O c) Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O Bài 3:
Bài 4: Giải Bài 5: Giải
nFe = nH2 = 0,025 (mol) ⇒ mFe = 0,025.56 = 1,4g
nFe = 0,025.2 = 0,05 (mol) ⇒ mFe = 0,05.56 = 2,8g Fe + CuSO4 → FeSO4 + Cu↑ ⇒ nFe = nCu = 0,05.64 = 3,2g |
..........................................
Tài liệu còn nhiều, mời bạn tải xuống để xem đầy đủ!

 Cho 3 mẫu hợp kim trên tác dụng với dung dịch NaOH, mẫu nào không thấy sủi bọt khí là mẫu Cu – Fe.
Cho 3 mẫu hợp kim trên tác dụng với dung dịch NaOH, mẫu nào không thấy sủi bọt khí là mẫu Cu – Fe.