Trắc nghiệm Hóa học 10 Bài 11 (có đáp án): Liên kết cộng hóa trị - Cánh diều
Haylamdo biên soạn và sưu tầm 10 bài tập trắc nghiệm Hóa học 10 Bài 11: Liên kết cộng hóa trị sách Cánh diều có đáp án và lời giải chi tiết đầy đủ các mức độ sẽ giúp học sinh ôn luyện trắc nghiệm để biết cách làm các dạng bài tập Hóa 10
Trắc nghiệm Hóa học 10 Bài 11 (có đáp án): Liên kết cộng hóa trị - Cánh diều
Câu 1. Liên kết cộng hóa trị là liên kết được hình thành bởi
A. lực hút tĩnh điện giữa các ion trái dấu.
B. một hay nhiều cặp electron chung giữa hai nguyên tử.
C. lực hút tĩnh điện giữa các ion cùng dấu.
D. sự cho và nhận electron giữa hai nguyên tử.
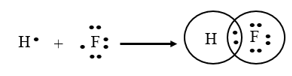
Câu 2. Liên kết giữa nguyên tử H và F trong phân tử HF được tạo nên bởi
A. 1 cặp electron chung.
B. 2 cặp electron chung.
C. 3 cặp electron chung.
D. 4 cặp electron chung.
Câu 3. Công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng gọi là
A. công thức cộng hóa trị.
B. công thức electron.
C. công thức Lewis.
D. công thức ion.
Câu 4. Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn
A. bằng một mũi tên (→) và goi là liên kết đơn.
B. bằng một nối ba () và goi là liên kết ba.
C. bằng một nối đôi (=) và goi là liên kết đôi.
D. bằng một nối đơn (–) và goi là liên kết đơn.
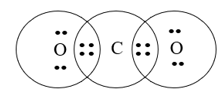
Câu 5. Công thức cấu tạo của CO2 là
A. O-C-O.
B. C-O-O.
C. O=C=O.
D. O=C-O.
Câu 6. Liên kết giữa 2 nguyên tử N trong phân tử N2 là
A. liên kết đôi.
B. liên kết ba.
C. liên kết đơn.
D. liên kết ion.
Câu 7. Liên kết mà cặp electron chung được đóng góp từ một nguyên tử được gọi là
A. liên kết ion.
B. liên kết hiđro.
C. liên kết cộng hóa trị có cực.
D. liên kết cho – nhận.
Câu 8. Trong phân tử nào đây có chứa liên kết cho nhận?
A. HCl.
B. O2.
C. NaCl.
D. SO2.
Câu 9. Nguyên tử A và B có độ âm điện lần lượt là (A) , (B) ((B) ≥ (A) ). Hiệu độ âm điện giữa hai nguyên tử A, B là = (B) - (A). Nếu liên kết giữa hai nguyên tử A và B là liên kết cộng hóa trị có cực thì
A. 0 ≤ < 0,4.
B. 0,4 ≤ < 1,7.
C. ≥ 1,7.
D. 1,7 ≤ < 4,0.
Câu 10. Liên kết giữa hai nguyên tử Cl trong phân tử Cl2 là
A. liên kết cộng hóa trị không cực.
B. liên kết cộng hóa trị có cực.
C. liên kết ion.
D. liên kết cho – nhận.
Câu 11. Cho biết độ âm điện của nguyên tử H và Cl lần lượt là 2,2 và 3,2. Liên kết giữa nguyên tử H và Cl trong phân tử HCl là
A. liên kết ion.
B. liên kết cộng hóa trị không cực.
C. liên kết cộng hóa trị có cực.
D. liên kết cho – nhận.
Câu 12. Liên kết ba gồm
A. 3 liên kết s.
B. 1 liên kết s và 2 liên kết p.
C. 2 liên kết s và 1 liên kết p.
D. 1 liên kết s và 1 liên kết p.
Câu 13. Cho các phát biểu sau:
(1) Trong phân tử HCl, cặp electron chung bị lệch về phía nguyên tử H.
(2) Liên kết s kém bền hơn liên kết p.
(3) Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma (s).
(4) Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (p).
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14. Năng lượng cần thiết để phá vỡ một loại liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar được gọi là
A. năng lượng nguyên tử.
B. năng lượng hạt nhân.
C. năng lượng liên kết.
D. năng lượng hóa học.
Câu 15. Cho biết năng lượng liên kết của H–F là 565 KJ mol-1; H–Cl là 431 KJ mol-1; H–Br là 364 KJ mol-1; H–I là 297 KJ mol-1. Trong các liên kết trên, liên kết nào bền nhất?
A. H–F.
B. H–Cl.
C. H–Br.
D. H–I.
Câu 1:
Liên kết cộng hóa trị là liên kết được hình thành bởi
A. lực hút tĩnh điện giữa các ion trái dấu.
B. một hay nhiều cặp electron chung giữa hai nguyên tử.
C. lực hút tĩnh điện giữa các ion cùng dấu.
D. sự cho và nhận electron giữa hai nguyên tử.
Câu 2:
Liên kết giữa nguyên tử H và F trong phân tử HF được tạo nên bởi
A. 1 cặp electron chung.
B. 2 cặp electron chung.
C. 3 cặp electron chung.
D. 4 cặp electron chung.
Câu 3:
Công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng gọi là
A. công thức cộng hóa trị.
B. công thức electron.
C. công thức Lewis.
D. công thức ion.
Câu 4:
Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn
A. bằng một mũi tên () và goi là liên kết đơn.
B. bằng một nối ba () và goi là liên kết ba.
C. bằng một nối đôi (=) và goi là liên kết đôi.
D. bằng một nối đơn (–) và goi là liên kết đơn.
Câu 6:
Liên kết giữa 2 nguyên tử N trong phân tử N2 là
A. liên kết đôi.
B. liên kết ba.
C. liên kết đơn.
D. liên kết ion.
Câu 7:
Liên kết mà cặp electron chung được đóng góp từ một nguyên tử được gọi là
A. liên kết ion.
B. liên kết hiđro.
C. liên kết cộng hóa trị có cực.
D. liên kết cho – nhận.
Câu 9:
Nguyên tử A và B có độ âm điện lần lượt là (A) , (B) ((B) ≥ (A) ). Hiệu độ âm điện giữa hai nguyên tử A, B là = (B) - (A). Nếu liên kết giữa hai nguyên tử A và B là liên kết cộng hóa trị có cực thì
A. 0 ≤ < 0,4.
B. 0,4 ≤ < 1,7.
C. ≥ 1,7.
D. 1,7 ≤ < 4,0.
Câu 10:
Liên kết giữa hai nguyên tử Cl trong phân tử Cl2 là
A. liên kết cộng hóa trị không cực.
B. liên kết cộng hóa trị có cực.
C. liên kết ion.
D. liên kết cho – nhận.
Câu 11:
Cho biết độ âm điện của nguyên tử H và Cl lần lượt là 2,2 và 3,2. Liên kết giữa nguyên tử H và Cl trong phân tử HCl là
A. liên kết ion.
B. liên kết cộng hóa trị không cực.
C. liên kết cộng hóa trị có cực.
D. liên kết cho – nhận.
Câu 12:
Liên kết ba gồm
A. 3 liên kết .
B. 1 liên kết và 2 liên kết .
C. 2 liên kết và 1 liên kết .
D. 1 liên kết và 1 liên kết .
Câu 13:
Cho các phát biểu sau:
(1) Trong phân tử HCl, cặp electron chung bị lệch về phía nguyên tử H.
(2) Liên kết kém bền hơn liên kết .
(3) Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma ().
(4) Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi ().
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14:
Năng lượng cần thiết để phá vỡ một loại liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar được gọi là
A. năng lượng nguyên tử.
B. năng lượng hạt nhân.
C. năng lượng liên kết.
D. năng lượng hóa học.
Câu 15:
Cho biết năng lượng liên kết của H–F là 565 KJ mol-1; H–Cl là 431 KJ mol-1; H–Br là 364 KJ mol-1; H–I là 297 KJ mol-1. Trong các liên kết trên, liên kết nào bền nhất?
A. H–F.
B. H–Cl.
C. H–Br.
D. H–I.