Trắc nghiệm Hóa học 10 Bài 16 (có đáp án): Tốc độ phản ứng hóa học - Cánh diều
Haylamdo biên soạn và sưu tầm 10 bài tập trắc nghiệm Hóa học 10 Bài 16: Tốc độ phản ứng hóa học sách Cánh diều có đáp án và lời giải chi tiết đầy đủ các mức độ sẽ giúp học sinh ôn luyện trắc nghiệm để biết cách làm các dạng bài tập Hóa 10
Trắc nghiệm Hóa học 10 Bài 16 (có đáp án): Tốc độ phản ứng hóa học - Cánh diều
Câu 1. Tốc độ phản ứng của một phản ứng hóa học là
A. đại lượng đặc trưng cho sự thay đổi số oxi hóa chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
B. đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
C. thời gian để phản ứng xảy ra hoàn toàn.
D. đại lượng đặc trưng cho sự thay đổi khối lượng của các chất rắn phản ứng trong một đơn vị thời gian.
Câu 2. Cho phản ứng tổng quát sau: aA + bB → mM + nN.
Công thức tính tốc độ trung bình của phản ứng (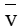
A.
B.
C.
D.
Câu 3. Cho phản ứng phân hủy N2O5: 2N2O5(g) → 4NO2(g) + O2(g). Biết nồng độ ban đầu của N2O5 là 0,0240M, nồng độ N2O5 sau 100s là 0,0168M. Tốc độ trung bình của phản ứng trong 100s đầu tiên là
A. 1,25×10-6 (M.s-1).
B. 1,25×10-5 (M.s-1).
C. 3,60×10-5 (M.s-1).
D. 3,60×10-6 (M.s-1).
Câu 4. Phát biểu nào sau đây không đúng?
A. Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
B. Tốc độ phản ứng có thể nhận giá trị dương hoặc âm.
C. Tốc độ trung bình của phản ứng là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
D. Tốc độ phản ứng nổ của khí bình gas lớn hơn tốc độ của phản ứng gỉ sắt.
Câu 5. Định luật tác dụng khối lượng: Tốc độ phản ứng
A. tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
B. tỉ lệ nghịch với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
C. tỉ lệ thuận với tích nồng độ các chất sản phẩm với số mũ thích hợp.
D. tỉ lệ nghịch với tích nồng độ các chất sản phẩm với số mũ thích hợp.
Câu 6. Cho phản ứng đơn giản có dạng: aA + bB → sản phẩm. Gọi CA, CB là nồng độ mol L-1 tương ứng của chất A và B, k là hằng số tốc độ phản ứng. Tốc độ phản ứng được tính theo công thức nào sau đây?
A. .
B. .
C. .
D. .
Câu 7. Phản ứng giữa H2 và N2 là phản ứng đơn giản: N2(g) + 3H2(g) → 2NH3(g). Theo định luật tác dụng khối lượng, tốc độ của phản ứng trên được viết dưới dạng:
A. .
B. .
C. .
D. .
Câu 8. Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi
A. nồng độ các chất phản ứng bằng nhau.
B. nồng độ các chất phản ứng bằng nhau và bằng 1M.
C. khối lượng của các chất phản ứng bằng nhau.
D. nồng độ các chất sản phẩm bằng nhau và bằng 1M.
Câu 9. Giá trị của hằng số tốc độ phản ứng (k) phụ thuộc vào
A. nhiệt độ và bản chất các chất phản ứng.
B. nhiệt độ và áp suất.
C. áp suất và bản chất các chất phản ứng.
D. nhiệt độ và độ ẩm.
Câu 10. Phản ứng của H2 và I2 là phản ứng đơn giản: H2(g) + I2(g) → 2HI(g). Nếu nồng độ của H2 tăng lên 3 lần thì tốc độ phản ứng thay đổi như thế nào?
A. tăng lên 3 lần.
B. giảm đi 3 lần.
C. tăng lên 9 lần.
D. giảm đi 9 lần.
Câu 11. Cho các yếu tố sau: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. Trong những yếu tố trên, có bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng?
A. 2.
B. 3.
C. 4.
D. 5.
Câu 12. Cho hai thí nghiệm sau:
Thí nghiệm 1: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 2M dư.
Thí nghiệm 2: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 0,5M dư.
So sánh tốc độ phản ứng ở hai thí nghiệm trên.
A. Tốc độ phản ứng của thí nghiệm 1 nhỏ hơn thí nghiệm 2.
B. Tốc độ phản ứng của thí nghiệm 1 lớn hơn thí nghiệm 2.
C. Tốc độ phản ứng của hai thí nghiệm bằng nhau.
D. Không thể so sánh được tốc độ phản ứng của hai thí nghiệm.
Câu 13. Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng
A. càng nhỏ.
B. càng ổn định.
C. càng lớn.
D. tăng gấp đôi.
Câu 14. Cho 4 gam kẽm hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ thường. Nếu giữ nguyên các điều kiện khác, chỉ biến đổi một trong các điều kiện sau đây:
(a) Thay 4 gam kẽm hạt bằng 4 gam kẽm bột.
(b) Thay dung dịch H2SO4 2M bằng dung dịch H2SO4 4M.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC).
(d) Dùng thể tích dung dịch H2SO4 2M gấp đôi ban đầu.
Số trường hợp làm tăng tốc độ phản ứng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 15. Cho các phát biểu sau:
(1) Với đa số các phản ứng, khi nhiệt độ tăng lên 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị = 2 – 4 này gọi là hệ số nhiệt độ Van’t Hoff.
(2) Chất xúc tác làm tăng tốc độ phản ứng, sau phản ứng khối lượng chất xúc tác giảm đi.
(3) Với phản ứng có = 2, nếu nhiệt độ tăng từ 20oC lên 50oC thì tốc độ phản ứng tăng lên 16 lần.
(4) Thức ăn chậm bị ôi, thiu hơn khi được bảo quản trong tủ lạnh.
(5) Bệnh nhân suy hô hấp cần thở oxygen thay vì không khí (chứa khoảng 21% thể tích oxygen).
Trong các phát biểu trên, số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 1:
Tốc độ phản ứng của một phản ứng hóa học là
A. đại lượng đặc trưng cho sự thay đổi số oxi hóa chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
B. đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
C. thời gian để phản ứng xảy ra hoàn toàn.
D. đại lượng đặc trưng cho sự thay đổi khối lượng của các chất rắn phản ứng trong một đơn vị thời gian.
Câu 2:
Cho phản ứng tổng quát sau: aA + bB mM + nN.
Công thức tính tốc độ trung bình của phản ứng (\[\overline v \]) nào sau đây không đúng? Biết C, t lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng.
A. \[\overline v = \frac{1}{a}\frac{{\Delta {C_A}}}{{\Delta t}}\].
B. \[\overline v = - \frac{1}{b}\frac{{\Delta {C_B}}}{{\Delta t}}\].
C. \[\overline v = \frac{1}{c}\frac{{\Delta {C_C}}}{{\Delta t}}\].
D. \[\overline v = \frac{1}{d}\frac{{\Delta {C_d}}}{{\Delta t}}\].
Câu 3:
Cho phản ứng phân hủy N2O5: 2N2O5(g) 4NO2(g) + O2(g). Biết nồng độ ban đầu của N2O5 là 0,0240M, nồng độ N2O5 sau 100s là 0,0168M. Tốc độ trung bình của phản ứng trong 100s đầu tiên là
A. 1,25×10-6 (M.s-1).
B. 1,25×10-5 (M.s-1).
C. 3,60×10-5 (M.s-1).
D. 3,60×10-6 (M.s-1).
Câu 4:
Phát biểu nào sau đây không đúng?
A. Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
B. Tốc độ phản ứng có thể nhận giá trị dương hoặc âm.
C. Tốc độ trung bình của phản ứng là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
D. Tốc độ phản ứng nổ của khí bình gas lớn hơn tốc độ của phản ứng gỉ sắt.
Câu 5:
Định luật tác dụng khối lượng: Tốc độ phản ứng
A. tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
B. tỉ lệ nghịch với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
C. tỉ lệ thuận với tích nồng độ các chất sản phẩm với số mũ thích hợp.
D. tỉ lệ nghịch với tích nồng độ các chất sản phẩm với số mũ thích hợp.
Câu 6:
Cho phản ứng đơn giản có dạng: aA + bB sản phẩm. Gọi CA, CB là nồng độ mol L-1 tương ứng của chất A và B, k là hằng số tốc độ phản ứng. Tốc độ phản ứng được tính theo công thức nào sau đây?
A. \[v = k{C_A}C_B^b\].
B. \[v = kC_A^a{C_B}\].
C. \[v = kC_A^aC_B^b\].
D. \[v = k{C_A}{C_B}\].
Câu 7:
Phản ứng giữa H2 và N2 là phản ứng đơn giản: N2(g) + 3H2(g) 2NH3(g). Theo định luật tác dụng khối lượng, tốc độ của phản ứng trên được viết dưới dạng:
A. \[v = k{C_{N{H_3}}}{C_{{H_2}}}\].
B. \[v = kC_{N{H_3}}^3{C_{{H_2}}}\].
C. \[v = kC_{_{N{H_3}}}^3C_{{H_2}}^3\].
D. \[v = k{C_{{N_2}}}C_{{H_2}}^3\].
Câu 8:
Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi
A. nồng độ các chất phản ứng bằng nhau.
B. nồng độ các chất phản ứng bằng nhau và bằng 1M.
C. khối lượng của các chất phản ứng bằng nhau.
D. nồng độ các chất sản phẩm bằng nhau và bằng 1M.
Câu 9:
Giá trị của hằng số tốc độ phản ứng (k) phụ thuộc vào
A. nhiệt độ và bản chất các chất phản ứng.
B. nhiệt độ và áp suất.
C. áp suất và bản chất các chất phản ứng.
D. nhiệt độ và độ ẩm.
Câu 10:
Phản ứng của H2 và I2 là phản ứng đơn giản: H2(g) + I2(g) 2HI(g). Nếu nồng độ của H2 tăng lên 3 lần thì tốc độ phản ứng thay đổi như thế nào?
A. tăng lên 3 lần.
B. giảm đi 3 lần.
C. tăng lên 9 lần.
D. giảm đi 9 lần.
Câu 11:
Cho các yếu tố sau: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. Trong những yếu tố trên, có bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng?
A. 2.
B. 3.
C. 4.
D. 5.
Câu 12:
Cho hai thí nghiệm sau:
Thí nghiệm 1: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 2M dư.
Thí nghiệm 2: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 0,5M dư.
So sánh tốc độ phản ứng ở hai thí nghiệm trên.
A. Tốc độ phản ứng của thí nghiệm 1 nhỏ hơn thí nghiệm 2.
B. Tốc độ phản ứng của thí nghiệm 1 lớn hơn thí nghiệm 2.
C. Tốc độ phản ứng của hai thí nghiệm bằng nhau.
D. Không thể so sánh được tốc độ phản ứng của hai thí nghiệm.
Câu 13:
Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng
A. càng nhỏ.
B. càng ổn định.
C. càng lớn.
D. tăng gấp đôi.
Câu 14:
Cho 4 gam kẽm hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ thường. Nếu giữ nguyên các điều kiện khác, chỉ biến đổi một trong các điều kiện sau đây:
(a) Thay 4 gam kẽm hạt bằng 4 gam kẽm bột.
(b) Thay dung dịch H2SO4 2M bằng dung dịch H2SO4 4M.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC).
(d) Dùng thể tích dung dịch H2SO4 2M gấp đôi ban đầu.
Số trường hợp làm tăng tốc độ phản ứng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 15:
Cho các phát biểu sau:
(1) Với đa số các phản ứng, khi nhiệt độ tăng lên 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị = 2 – 4 này gọi là hệ số nhiệt độ Van’t Hoff.
(2) Chất xúc tác làm tăng tốc độ phản ứng, sau phản ứng khối lượng chất xúc tác giảm đi.
(3) Với phản ứng có = 2, nếu nhiệt độ tăng từ 20oC lên 50oC thì tốc độ phản ứng tăng lên 16 lần.
(4) Thức ăn chậm bị ôi, thiu hơn khi được bảo quản trong tủ lạnh.
(5) Bệnh nhân suy hô hấp cần thở oxygen thay vì không khí (chứa khoảng 21% thể tích oxygen).
Trong các phát biểu trên, số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 5.