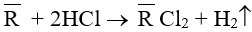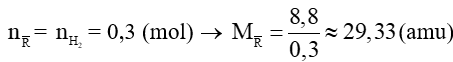Trắc nghiệm Hóa học 10 Bài 9 (có đáp án): Quy tắc octet - Cánh diều
Haylamdo biên soạn và sưu tầm 10 bài tập trắc nghiệm Hóa học 10 Bài 9: Quy tắc octet sách Cánh diều có đáp án và lời giải chi tiết đầy đủ các mức độ sẽ giúp học sinh ôn luyện trắc nghiệm để biết cách làm các dạng bài tập Hóa 10
Trắc nghiệm Hóa học 10 Bài 9 (có đáp án): Quy tắc octet - Cánh diều
Câu 1. Theo quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng
A. nhận electron để hình thành lớp vỏ bền vững.
B. nhường electron để hình thành lớp vỏ bền vững.
C. hình thành lớp vỏ bền vững như của khí hiếm.
D. góp chung electron để hình thành lớp vỏ bền vững.
Câu 2. Cho nguyên tử các nguyên tố sau: Na (Z = 11); P (Z = 15); Ne (Z = 10). Trong các nguyên tử trên, nguyên tử có lớp electron ngoài cùng bền vững là
A. Ne.
B. Na.
C. P.
D. Ne và Na.
Câu 3. Nguyên tử chlorine có Z = 17. Xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học là
A. nhường 1 electron.
B. nhận 1 electron.
C. nhường 2 electron.
D. nhận 2 electron.
Câu 4. Oxygen có Z = 8, xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học là
A. nhận 2 electron.
B. nhường 2 electron.
C. nhận 1 electron.
D. nhường 1 electron.
Câu 5. Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng
A. nhường 5, 6 hoặc 7 electron để đạt 8 electron ở lớp ngoài cùng.
B. nhường 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng.
C. nhận 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng.
D. nhận 5, 6 hoặc 7 electron để đạt 8 electron ở lớp ngoài cùng.
Câu 6. Nguyên tử sodium có Z = 11. Xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hóa học là
A. nhường 2 electron.
B. nhường 1 electron.
C. nhận 2 electron.
D. nhận 1 electron.
Câu 7. Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng
A. nhận 1, 2 hoặc 3 electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
B. nhận 7, 6 hoặc 5 electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
C. nhường 7, 6 hoặc 5 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
D. nhường 1, 2 hoặc 3 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
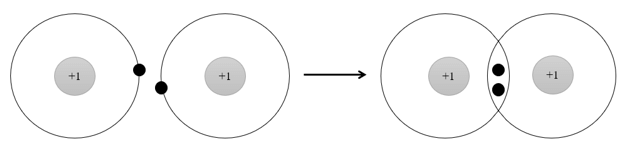
Câu 8. Phân tử H2 được hình thành từ
A. 2 nguyên tử H, trong đó mỗi nguyên tử H nhường đi 1 electron.
B. 2 nguyên tử H bởi sự góp chung electron.
C. 2 nguyên tử H, trong đó mỗi nguyên tử H nhận thêm 1 electron.
D. 2 nguyên tử H, trong đó 1 nguyên tử H nhận thêm 1 electron và 1 nguyên tử H nhường đi 1 electron.
Câu 9. Nguyên tử P (Z = 15) có xu hướng
A. nhường 5 electron.
B. nhường 3 electron.
C. nhận 5 electron.
D. nhận 3 electron.
Câu 10. Nguyên tử Al (Z = 13) có xu hướng
A. nhận 3 electron.
B. nhường 3 electron.
C. nhận 5 electron.
D. nhường 5 electron.
Câu 11. Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Boron (Z = 5).
B. Potassium (Z = 19).
C. Magnesium (Z = 12).
D. Flourine (Z = 9).
Câu 12. Cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Phần trăm khối lượng của R trong oxide cao nhất là
A. 25,81%.
B. 67,82%.
C. 32,18%.
D. 74,19%.
Câu 13. Cation M+ và anion X- đều có cấu hình electron phân lớp ngoài cùng là 3p6. Cho đơn chất M tác dụng với đơn chất X thu được sản phẩm là
A. NaCl.
B. KCl.
C. NaBr.
D. KBr.
Câu 14. Cho 6,72 gam một kim loại M tác dụng với dung dịch H2SO4 loãng, dư, thu được 2,688 lít khí (ở đktc). Kim loại M là
A. Mg.
B. Fe.
C. Zn.
D. Al.
Câu 15. Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp và đều thuộc nhóm IIA của bảng tuần hoàn tác dụng với lượng dư dung dịch HCl, sau phản ứng thu được 6,72 lít khí ở đktc. Hai kim loại đó là
A. Be và Mg.
B. Ca và Sr.
C. Mg và Ca.
D. Sr và Ba.
Câu 1:
Theo quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng
A. nhận electron để hình thành lớp vỏ bền vững.
B. nhường electron để hình thành lớp vỏ bền vững.
C. hình thành lớp vỏ bền vững như của khí hiếm.
D. góp chung electron để hình thành lớp vỏ bền vững.
Câu 2:
Cho nguyên tử các nguyên tố sau: Na (Z = 11); P (Z = 15); Ne (Z = 10). Trong các nguyên tử trên, nguyên tử có lớp electron ngoài cùng bền vững là
A. Ne.
B. Na.
C. P.
D. Ne và Na.
Câu 3:
Nguyên tử chlorine có Z = 17. Xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học là
A. nhường 1 electron.
B. nhận 1 electron.
C. nhường 2 electron.
D. nhận 2 electron.
Câu 4:
Oxygen có Z = 8, xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học là
A. nhận 2 electron.
B. nhường 2 electron.
C. nhận 1 electron.
D. nhường 1 electron.
Câu 5:
Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng
A. nhường 5, 6 hoặc 7 electron để đạt 8 electron ở lớp ngoài cùng.
B. nhường 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng.
C. nhận 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng.
D. nhận 5, 6 hoặc 7 electron để đạt 8 electron ở lớp ngoài cùng.
Câu 6:
Nguyên tử sodium có Z = 11. Xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hóa học là
A. nhường 2 electron.
B. nhường 1 electron.
C. nhận 2 electron.
D. nhận 1 electron.
Câu 7:
Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng
A. nhận 1, 2 hoặc 3 electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
B. nhận 7, 6 hoặc 5 electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
C. nhường 7, 6 hoặc 5 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
D. nhường 1, 2 hoặc 3 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
Câu 8:
Phân tử H2 được hình thành từ
A. 2 nguyên tử H, trong đó mỗi nguyên tử H nhường đi 1 electron.
B. 2 nguyên tử H bởi sự góp chung electron.
C. 2 nguyên tử H, trong đó mỗi nguyên tử H nhận thêm 1 electron.
D. 2 nguyên tử H, trong đó 1 nguyên tử H nhận thêm 1 electron và 1 nguyên tử H nhường đi 1 electron.
Câu 9:
Nguyên tử P (Z = 15) có xu hướng
A. nhường 5 electron.
B. nhường 3 electron.
C. nhận 5 electron.
D. nhận 3 electron.
Câu 10:
Nguyên tử Al (Z = 13) có xu hướng
A. nhận 3 electron.
B. nhường 3 electron.
C. nhận 5 electron.
D. nhường 5 electron.
Câu 11:
Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Boron (Z = 5).
B. Potassium (Z = 19).
C. Magnesium (Z = 12).
D. Flourine (Z = 9).
Câu 12:
Cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Phần trăm khối lượng của R trong oxide cao nhất là
A. 25,81%.
B. 67,82%.
C. 32,18%.
D. 74,19%.
Câu 13:
Cation M+ và anion X- đều có cấu hình electron phân lớp ngoài cùng là 3p6. Cho đơn chất M tác dụng với đơn chất X thu được sản phẩm là
A. NaCl.
B. KCl.
C. NaBr.
D. KBr.
Câu 14:
Cho 6,72 gam một kim loại M tác dụng với dung dịch H2SO4 loãng, dư, thu được 2,688 lít khí (ở đktc). Kim loại M là
A. Mg.
B. Fe.
C. Zn.
D. Al.
Câu 15:
Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp và đều thuộc nhóm IIA của bảng tuần hoàn tác dụng với lượng dư dung dịch HCl, sau phản ứng thu được 6,72 lít khí ở đktc. Hai kim loại đó là
A. Be và Mg.
B. Ca và Sr.
C. Mg và Ca.
D. Sr và Ba.

 (hóa trị II).
(hóa trị II).