Tính lượng nhiệt sinh ra khi đốt cháy hoàn toàn 7,8 gam C6H6 (l) Cho enthalpy tạo thành chuẩn
Câu hỏi:
Tính lượng nhiệt sinh ra khi đốt cháy hoàn toàn 7,8 gam C6H6 (l)
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
|
Chất
|
C6H6 (l)
|
CO2 (g)
|
H2O (g)
|
|
 (kJ/mol) (kJ/mol)
|
+49
|
− 393,5
|
-241,82
|
A. 3135,46 kJ;
B. 684,32 kJ;
C. 313,546 kJ;
D. 68,432 kJ.
Trả lời:
Đáp án đúng là: C
C6H6 (l) +  O2 (g) ⟶ 6CO2 (g) + 3H2O (g)
O2 (g) ⟶ 6CO2 (g) + 3H2O (g)
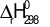 =
= 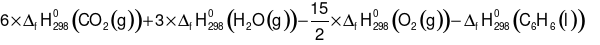
= 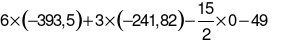
= − 3135,46 (kJ)
Do đó, đốt cháy 1 mol C6H6 thì lượng nhiệt sinh ra là 3135,46 kJ
7,8 gam C6H6 (l) có số mol là:  = 0,1 (mol).
= 0,1 (mol).
Vậy đốt cháy 0,1 mol C6H6 thì lượng nhiệt sinh ra là 3135,46.0,1 = 313,546 (kJ)
Xem thêm bài tập trắc nghiệm Hóa 10 CTST có lời giải hay khác:
Câu 1:
Sự phá vỡ liên kết cần ….. năng lượng, sự hình thành liên kết …... năng lượng.
Cụm từ tích hợp điền vào chỗ chấm trên lần lượt là
Xem lời giải »
Câu 2:
Cho phản ứng có dạng: aA (g) + bB (g) ⟶ mM (g) + nN (g)
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết Eb là
Xem lời giải »
Câu 4:
Cho phản ứng sau ở điều kiện chuẩn:
2H2 (g) + O2 (g)  2H2O (g)
2H2O (g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
Xem lời giải »
Câu 5:
Cho phương trình nhiệt hóa học sau:
SO2 (g) +  O2 (g)
O2 (g) 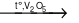 SO3 (g)
SO3 (g) 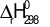 = − 98,5 kJ
= − 98,5 kJ
Lượng nhiệt giải phóng ra khi chuyển 76,8 gam SO2 (g) thành SO3 (g) là
Xem lời giải »
Câu 6:
Cho phương trình nhiệt hóa học sau:
2H2 (g) + O2 (g) ⟶ 2H2O (g) 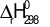 = − 483,64 kJ
= − 483,64 kJ
So sánh đúng là
Xem lời giải »
 O2 (g) ⟶ 6CO2 (g) + 3H2O (g)
O2 (g) ⟶ 6CO2 (g) + 3H2O (g)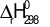 =
= 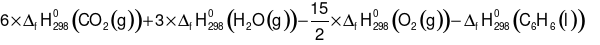
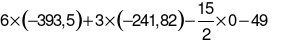
 = 0,1 (mol).
= 0,1 (mol).
 (kJ/mol)
(kJ/mol) 2H2O (g)
2H2O (g) O2 (g)
O2 (g)  SO3 (g)
SO3 (g) 