Giải Hóa học 11 trang 15 Chân trời sáng tạo
Haylamdo biên soạn và sưu tầm Với Lời Giải Hóa học 11 trang 15 trong Bài 2: Cân bằng trong dung dịch nước Hóa học lớp 11 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 11 trang 15.
Giải Hóa học 11 trang 15 Chân trời sáng tạo
Câu hỏi thảo luận 8 trang 15 Hóa học 11: Tính pH của dung dịch có nồng độ H+ là 10-2 M.
Lời giải:
pH = -log[H+] = -log[10-2] = 2.
Câu hỏi thảo luận 9 trang 15 Hóa học 11: Tính pH của dung dịch có nồng độ OH- là 10-4 M.
Lời giải:
Ta có: Kw = [H+].[OH-]
pH = -log[H+] = -log[10-10] = 10.
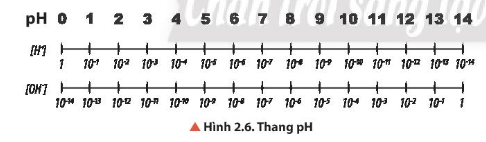
Câu hỏi thảo luận 10 trang 15 Hóa học 11: Quan sát Hình 2.6, cho biết khoảng giá trị nào trong thang pH tương ứng với môi trường của dung dịch là acid, base hay trung tính.
Lời giải:
- Môi trường trung tính: [H+] = [OH-] = 10-7 M hay pH = 7.
- Môi trường acid: [H+] > [OH-] hay [H+] > 10-7 M hay pH < 7.
- Môi trường base: [H+] < [OH-] hay [H+] < 10-7 M hay pH > 7.
Luyện tập trang 15 Hóa học 11:
a) Pha 500 mL dung dịch HCl 0,2 M vào 500 mL nước. Tính pH của dung dịch thu được.
b) Tính khối lượng NaOH cần để pha 100 mL dung dịch NaOH có pH = 12.
Lời giải:
a) HCl → H+ + Cl-
nH+ = nHCl = 0,5.0,2 = 0,1 mol.
[H+] =
pH của dung dịch thu được: pH = -log[H+] = -log[0,1] = 1.
b) NaOH → Na+ + OH-
pH = 12 Þ [H+] = 10-12 M Þ [OH-] = 10-2 M.
nOH- = 10-2.0,1 = 10-3 (mol).
Khối lượng NaOH cần dùng là: mNaOH = 10-3.40 = 0,04 gam.
Lời giải Hóa 11 Bài 2: Cân bằng trong dung dịch nước hay khác: