Lý thuyết Hóa học 11 (Chân trời sáng tạo) Bài 18: Hợp chất carbonyl có đáp án
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Hóa 11 Bài 18: Hợp chất carbonyl sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Bài 18: Hợp chất carbonyl - Hóa học 11 Chân trời sáng tạo
I. Khái niệm, đặc điểm liên kết
- Hợp chất carbonyl là hợp chất chứa nhóm carbonyl trong phân tử
Ví dụ:
Aldehyde no, đơn chức, mạch hở (CnH2nO, n≥ 1): Methanal HCHO, ethanal CH3CHO,…
Aldehyde không no: Acrolein CH2 = CHCHO
Aldehyde thơm: Benzaldehyde C6H5CHO
Ketone no: Acetone CH3COCH3, ethyl methyl ketone CH3CH2COCH3,…
II. Danh pháp
- Aldehyde: Tên theo danh pháp thay thế của aldehyde đơn chức, mạch hở:
Tên hydrocarbon tương ứng (bỏ kí tự e ở cuối) + al
Đánh số các nguyên tử carbon ở mạch chính bắt đầu từ ở nguyên tử carbon của nhóm –CHO.
Ví dụ: C2H5CHO: propanal
(CH3)2CHCH2CHO: 3-methylbutanal
- Ketone: Tên theo danh pháp thay thế của ketone đơn chức mạch hở:
Tên hydrocarbon tương ứng (bỏ kí tự e ở cuối) + Số chỉ vị trí nhóm carbonyl + one
Đánh số các nguyên tử carbon ở mạch chính bắt đầu từ nguyên tử carbon gần nhóm >C=O nhất.
Ví dụ: CH3COCH2CH3: Butanone
CH2COCH=CH2: But-3-en-2-one
C6H5CH2COCH3: 1-phenylpropan-2-one
III. Tính chất vật lí
- Formaldehyde và acetadehyde là những chất khí ở nhiệt độ thường. Các hợp chất carbonyl khác là chất lỏng hoặc rắn.
- Aldehyde, ketone có nhiệt sôi thấp hơn so với alcohol tương ứng. Các hợp chất carbonyl có nhiệt độ sôi cao hơn nhiều so với hydrocarbon có phân tử khối tương đương do phân tử chứa nhóm carbonyl phân cực làm phân tử các hợp chất carbonyl phân cực.
- Các alhehyde, ketone có mạch carbon ngắn dễ tan trong nước nhờ có liên kết hydrogen với nước. Các aldehyde, ketone có mạch carbon dài hơn đều ít tan hoặc không tan trong nước. Các aldehyde, ketone thơm hầu như không tan.
- Aldehyde, ketone thường có mùi đặc trưng.
IV. Tính chất hoá học
Nhóm >C=O quyết định tính chất hoá học đặc trưng của aldehyde, ketone
1. Phản ứng khử aldehyde, ketone
Với chất khử là LiAlH4 hoặc NaBH4 thì
+ Andehyde bị khử tạo thành alcohol bậc I.
+ Ketone bị khử tạo thành alcohol bậc II.
Ví dụ:
2. Phản ứng oxi hoá aldehyde
- Khi tác dụng với nước bromine, aldehyde bị oxi hoá tạo thành acid
- Phản ứng với thuốc thử Tollens (phản ứng tráng bạc) và Cu(OH)2/OH- là phản ứng đặc trưng của aldyhyde, thường dùng để nhận biết các aldehyde.
CH3CHO + 2[Ag(NH3)2OH] CH3COONH4 + 2Ag↓ + 3NH3 + H2O
CH3CHO + 2Cu(OH)2 + NaOH → CH3COONa + Cu2O↓ + 3H2O
Copper (II) oxide (màu đỏ gạch)
- Ketone không tham gia các phản ứng trên.
3. Phản ứng cộng và phản ứng tạo iodoform
- Aldehyde, ketone có phản ứng cộng với HCN tạo thành sản phẩm cyanohydrin.
- Các aldehyde và ketone có nhóm methyl cạnh nhóm carbonyl (CH3CO-) tham gia được phản ứng tạo iodoform.
CH3-CHO + 3I2 + 4NaOH → CHI3↓ + H-COONa + 3NaI + 3H2O
CH3COCH3 + 3I2 + 4NaOH → CHI3↓ + CH3COONa + 3NaI + 3H2O
V. Ứng dụng của hợp chất carbonyl
Aldehyde và ketone có nhiều ứng dụng trong sản xuất và đời sống hàng ngày.
- Formaldehyde: ứng dụng trong công nghiệp dệt, nhựa, chất dẻo, xây dựng, mỹ phẩm, kéo dán, thuốc nổ, giấy than, mực máy photocopy,…
- Acetaldehyde đượng dùng nhiều trong tổng hợp hữu cơ. Ví dụ sản xuất acetic acid, acetic anhydride, butanol,…
- Acetone là dung môi tốt, trong sản xuất tơ nhân tạo, thuốc súng không khói, dùng để pha loãng nhựa polyester và được sử dụng trong các chất tẩy rửa,…
- Benzaldehyde được dùng để sản xuất phẩm nhuộm và nhiều hoá chất khác nhau.
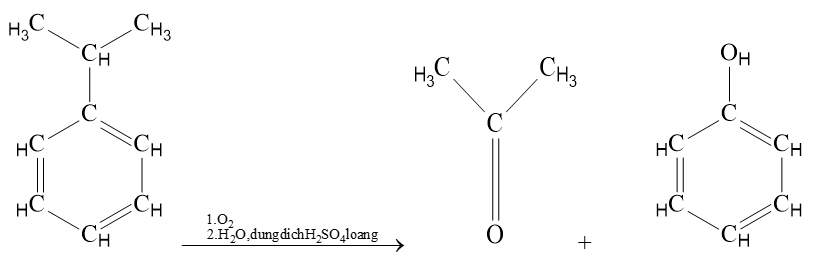
VI. Điều chế
1. Aldehyde được điều chế từ ethene (ethylene) C2H4
2. Acetone được điều chế từ cumene