2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ - Cân bằng phương trình hoá học
Phản ứng hoá học:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Điều kiện phản ứng
- Điều kiện thường.
Cách thực hiện phản ứng
- Nhỏ 2ml NaOH đặc vào ống nghiệm chứa 1 mẩu nhôm.
Hiện tượng nhận biết phản ứng
- mẩu nhôm tan dần, có khí thoát ra.
Bạn có biết
- nhôm có thể tác dụng với dung dịch kiềm và giải phóng hidro.

Ví dụ minh họa
Ví dụ 1:
NaOH không phản ứng với chất nào sau đây?
A. Al. B. Al2O3. C. Al(OH)3. D. Fe.
Hướng dẫn giải
Fe không phản ứng với NaOH.
Đáp án D.
Ví dụ 2:
Phát biểu nào dưới đây là đúng?
A. Nhôm là một kim loại lưỡng tính.
B. Al(OH)3 là bazơ lưỡng tính.
C. Nhôm có thể tan trong dung dịch kiềm, giải phóng H2.
D. Al2O3 là oxit trung tính.
Hướng dẫn giải
Nhôm có thể tan trong dung dịch kiềm, giải phóng H2.
Đáp án C.
Ví dụ 3:
Cho 0,4g NaOH hòa tan vào nước được dung dịch X. Lượng dung dịch X trên phản ứng vừa đủ với lượng nhôm có số mol là
A. 0,1 mol. B. 1 mol. C. 0,01 mol. D. 0,2 mol.
Hướng dẫn giải
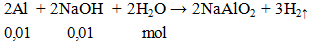
Đáp án C.

