2Al(NO3)3 + 4Ba(OH)2 → 3Ba(NO3)2 + 4H2O + Ba(AlO2)2 - Cân bằng phương trình hoá học
Phản ứng hoá học:
2Al(NO3)3 + 4Ba(OH)2 → 3Ba(NO3)2 + 4H2O + Ba(AlO2)2
Điều kiện phản ứng
- Nhiệt độ
Cách thực hiện phản ứng
- Cho Al(NO3)3 tác dụng với dung dịch Ba(OH)2
Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa rồi tủa tan trong dung dịch

Ví dụ minh họa
Ví dụ 1: Kết luận nào sau đây không đúng với nhôm?
A. Có bán kính nguyên tử lớn hơn Mg.
B. Là nguyên tố họ p
C. Là kim loại mà oxit và hidroxit lưỡng tính.
D. Trạng thái cơ bản nguyên tử có 1e độc thân.
Đáp án: A
Hướng dẫn giải
Mg thuộc nhóm IIA, Al thuộc nhóm IIIA và cùng thuộc chu kì 3 → bán kính của Mg > Al
Ví dụ 2: Nhôm không bị hoà tan trong dung dịch
A. HCl. B. HNO3 đặc, nguội.
C. HNO3 loãng D. H2SO4 loãng.
Đáp án: B
Hướng dẫn giải
Nhôm bị thụ động hóa trong HNO3 đặc nguội
Ví dụ 3: Nguyên liệu chính dùng để sản xuất nhôm là
A. quặng boxit. B. quặng pirit.
C. quặng đolomit. D. quặng manhetit.
Đáp án: A
Hướng dẫn giải
Thành phần chính của quặng Boxit là Al2O3

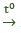 Al2O3 + 3H2O
Al2O3 + 3H2O