2KOH + H2SO4 → K2SO4+ 2H2O - Cân bằng phương trình hoá học
Phản ứng hoá học:
2KOH + H2SO4 → K2SO4+ 2H2O
Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
Cách thực hiện phản ứng
- Nhỏ từ từ H2SO4 vào dung dịch KOH có chứa một mẩu quỳ tím.
Hiện tượng nhận biết phản ứng
- Ban đầu mẩu quỳ tím có màu xanh, sau khi nhỏ từ từ H2SO4 mẩu quỳ mất màu, dư H2SO4 quỳ chuyển sang màu đỏ.
Bạn có biết
- Phản ứng giữa KOH và H2SO4 là phản ứng trung hòa.

Ví dụ minh họa
Ví dụ 1:
Cho 0,1 mol KOH phản ứng vừa đủ với 100ml H2SO4 aM. Giá trị của a là
A. 0,1. B. 0,01. C. 0,05. D. 0,5.
Hướng dẫn giải
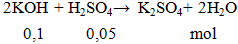
a = 0,05 : 0,1 = 0,5M.
Đáp án D.
Ví dụ 2:
Phản ứng nào sau đây không là phản ứng trung hòa?
A. KOH + HNO3 → KNO3 + H2O
B. 2KOH + H2SO4 → K2SO4+ 2H2O
C. KOH + HCl → KCl + H2O
D. 2KOH + CuSO4 → K2SO4 + Cu(OH)2
Hướng dẫn giải
2KOH + CuSO4 → K2SO4 + Cu(OH)2 không là phản ứng trung hòa
Đáp án D.
Ví dụ 3:
Cho 100ml H2SO4 0,1M phản ứng vừa đủ với dung dịch KOH thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
A. 1,74g. B. 1,01g. C. 0,754g. D. 1,10g.
Hướng dẫn giải
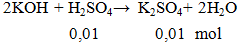
mmuối = 0,01.174 = 1,74 gam.
Đáp án A.

