2KOH + 2NaHS → K2S + Na2S + 2H2O - Cân bằng phương trình hoá học
Phản ứng hoá học:
2KOH + 2NaHS → K2S + Na2S + 2H2O
Điều kiện phản ứng
- điều kiện thường.
Cách thực hiện phản ứng
- Nhỏ từ từ KOH vào ống nghiệm có chứa NaHS và vài giọt chỉ thị.
Hiện tượng nhận biết phản ứng
- Quan sát sự chuyển màu của chỉ thị.
Bạn có biết
- KOH có thể phản ứng với muối hidro sunfua để thu được muối sunfua.

Ví dụ minh họa
Ví dụ 1:
KOH không phản ứng với dung dịch nào sau đây?
A. KHS. B. NaHS C. Na2S. D. H2S.
Hướng dẫn giải
Na2S không phản ứng với KOH.
Đáp án C.
Ví dụ 2:
Dẫn từ từ đến dư H2S vào dung dịch KOH thu được dung dịch X. Muối tan có trong dung dịch X là
A. K2S. B. K2S và KHS. C. KHS. D. K2S và KOH.
Hướng dẫn giải
Do H2S dư nên có phản ứng
KOH + H2S → KHS + H2O
Muối tan có trong dung dịch X là KHS.
Đáp án C.
Ví dụ 3:
Cho 0,56g KOH hòa tan vào nước được dung dịch X. Lượng dung dịch X trên phản ứng vừa đủ với dung dịch NaHS. Khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 1 gam. B, 0,94 gam. C. 0,78 gam. D. 1,1 gam.
Hướng dẫn giải
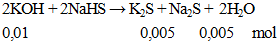
khối lượng muối = 0,005 (110 + 78) =0,94 gam.
Đáp án B.

