Top 150 Đề thi Hóa học 10 Kết nối tri thức có đáp án
Bộ 100 Đề thi Hóa học lớp 10 Kết nối tri thức năm học 2023 mới nhất đầy đủ Học kì 1 và Học kì 2 gồm đề thi giữa kì, đề thi học kì có đáp án chi tiết, cực sát đề thi chính thức giúp học sinh ôn luyện & đạt điểm cao trong các bài thi Hóa học 10.
Mục lục Đề thi Hóa học lớp 10 Kết nối tri thức năm 2023 mới nhất
Chỉ 150k mua trọn bộ Đề thi Hóa 10 Kết nối tri thức cả năm bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
- Đề thi Hóa 10 Giữa kì 1 Kết nối tri thức
- Đề thi Hóa 10 Học kì 1 Kết nối tri thức
- Đề thi Hóa 10 Giữa kì 2 Kết nối tri thức
- Đề thi Hóa 10 Học kì 2 Kết nối tri thức
Xem thêm đề thi Hóa 10 cả ba sách:
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Kết nối tri thức
Năm học 2023
Môn: Hóa học lớp 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Hóa học là ngành khoa học thuộc lĩnh vực nào sau đây?
A.Khoa học hình thức.
B.Khoa học xã hội.
C.Khoa học tự nhiên.
D.Khoa học ứng dụng.
Câu 2: Hầu hết hạt nhân các nguyên tử được cấu tạo bởi các loại hạt nào sau đây?
A. Proton và electron.
B. Proton, electron và neutron.
C. Proton và neutron.
D. Electron và neutron.
Câu 3: Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
A. Electron, m ≈ 1 amu, q = -1.
B. Proton, m≈ 1 amu, q = -1.
C. Proton, m ≈ 0,00055 amu, q = +1.
D. Neutron, m ≈ 1 amu, q = 0.
Câu 4: Nguyên tử fluorine chứa 9 electron và có số khối là19. Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là
A. 30. B. 32. C. 19. D. 28.
Câu 5: Số hiệu nguyên tử cho biết thông tin nào sau đây?
A. Số khối.
B. Nguyên tử khối trung bình.
C. Số proton.
D. Số neutron.
Câu 6: Cho kí hiệu nguyên tử sau: 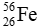
A. Số đơn vị điện tích hạt nhân là 26.
B. Tổng số proton và số neutron là 26.
C. Số neutron là 30.
D. Số khối là 56.
Câu 7: Nguyên tử magnesium có 12 electron. Điện tích hạt nhân của nguyên tử này là
A.12+. B.12. C.+12. D.-12.
Câu 8: Trong tự nhiên, nguyên tố bromine có 2 đồng vị. Trong đó 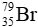
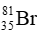
A.79,5.
B.79,1.
C.80,01.
D.35.
Câu 9: Số orbital trong các phân lớp s, p, d lần lượt là
A. 3, 5, 7.
B. 1, 2, 3.
C. 1, 3, 5.
D. 1, 2, 4.
Câu 10: Số electron tối đa trong lớp M là
A. 8. B. 18. C. 32. D. 2.
Câu 11: Ở trạng thái cơ bản, số electron độc thân trong nguyên tử O (Z = 8) là
A.0. B.1. C.3. D.2.
Câu 12: Nguyên tử X có 3 lớp electron, lớp thứ ba có 2 electron. Số hiệu nguyên tử X là
A.12. B.13. C.14. D.15.
Câu 13: Cấu hình electron nguyên tử chlorine (Z = 17) là
A. 1s22s22p63s23p2.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p3.
D. 1s22s22p63s23p4.
Câu 14: Cho biết nguyên tố A có 15 proton trong hạt nhân. A là
A.kim loại.
B.phi kim.
C.khí hiếm.
D.khí trơ.
Câu 15: Nguyên tử các nguyên tố thuộc cùng một chu kì có cùng đặc điểm nào sau đây?
A.Số electron.
B.Số lớp electron.
C.Số electron hóa trị.
D. Số electron ở lớp ngoài cùng.
Câu 16: Bảng tuần hoàn hiện nay gồm
A. 18 chu kì, trong đó 8 chu kì nhỏ và 10 chu kì lớn.
B. 7 chu kì, trong đó 3 chu kì nhỏ và 4 chu kì lớn.
C. 7 chu kì, trong đó 4 chu kì nhỏ và 3 chu kì lớn.
D. 8 chu kì, trong đó 4 chu kì nhỏ và 4 chu kì lớn.
Câu 17: Nguyên tố Cl (Z = 17) thuộc nhóm nào trong bảng tuần hoàn các nguyên tố hóa học?
A. IA. B. IIA. C. VA. D. VIIA.
Câu 18: Chu kì 2 trong bảng tuần hoàn gồm bao nhiêu nguyên tố?
A. 2 nguyên tố.
B. 8 nguyên tố.
C. 18 nguyên tố.
D. 32 nguyên tố.
Câu 19: Đại lượng nào sau đây trong nguyên tử của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Số lớp electron.
B. Số electron ở lớp ngoài cùng.
C. Nguyên tử khối.
D. Số electron trong nguyên tử.
Câu 20: Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIIA trong bảng tuần hoàn các nguyên tố hóa học đều là
A. np3.
B. ns3.
C. ns2np1.
D. ns2np4.
Câu 21: Theo độ âm điện của Pauling, nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn là
A.Fluorine.
B.Hydrogen.
C.Helium.
D.Oxygen.
Câu 22: Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần độ âm điện?
A. Rb, K, Na, Li.
B. Na, Li, K, Rb.
C. Na, K, Rb, Li.
D. Li, Rb, Na, K.
Câu 23: X là nguyên tố thuộc nhóm VIA trong bảng tuần hoàn. Công thức oxide ứng với hóa trị cao nhất của X là
A. X2O3. B. X2O6. C. X3O. D. XO3.
Câu 24: Trong các chất dưới đây, chất nào có tính acid mạnh nhất?
A. H2SO4.
B. HClO4.
C. H3PO4.
D. H2SiO3.
Câu 25: Khi xếp theo chiều tăng dần của điện tích hạt nhân, đại lượng nào sau đây không biến đổi tuần hoàn?
A. Bán kính nguyên tử.
B. Số neutron.
C. Tính kim loại, tính phi kim.
D. Độ âm điện.
Câu 26: Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s22s22p6.
B. 1s22s22p63s23p1.
C. 1s22s22p63s3.
D. 1s22s22p63s2.
Câu 27: Nguyên tử nguyên tố G có cấu hình electron là [Ne]3s23p4. Vị trí của G trong bảng tuần hoàn là
A.ô thứ 16, chu kì 3, nhóm VIA.
B.ô thứ 26, chu kì 3, nhóm IVB.
C.ô thứ 16, chu kì 2, nhóm IVA.
D.ô thứ 26, chu kì 3, nhóm VIA.
Câu 28: Cho X (Z = 9), Y (Z = 17) và T (Z = 16). Các nguyên tố được sắp xếp theo thứ tự bán kính nguyên tử tăng dần là
A.X, Y, T.
B.T, Y, X.
C.X, T, Y.
D.Y, T, X.
Phần II. Tự luận (3 điểm)
Câu 1 (1 điểm): Chlorine có hai đồng vị bền là 35Cl và 37Cl. Nguyên tử khối trung bình của chlorine là 35,45. Tính tỉ lệ phần trăm số nguyên tử mỗi đồng vị của chlorine trong tự nhiên.
Câu 2 (1 điểm): Cation M+ và anion Y2- đều có cấu hình electron lớp ngoài cùng là 3s23p6. Hãy xác định vị trí của các nguyên tố M, Y trong bảng tuần hoàn, có giải thích ngắn gọn.
Câu 3 (1 điểm): Sắp xếp các nguyên tố sau: 3Li, 8O, 9F, 11Na theo chiều tăng dần bán kính nguyên tử, có giải thích ngắn gọn.
Phòng Giáo dục và Đào tạo ...
Đề thi Học kì 1 - Kết nối tri thức
Năm học 2023
Môn: Hóa học lớp 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
A. Sự dao động của con lắc lò xo.
B. Vật chất, năng lượng và sự vận động của chúng.
C. Môi trường sống của ếch.
D. Chất và sự biến đổi của chất.
Câu 2: Nguyên tử sodium có 11 proton, 11 electron và 12 neutron. Số khối của hạt nhân nguyên tử sodium là
A. 22. B. 23. C. 24. D. 34.
Câu 3: Cho các nguyên tử sau: X (Z = 8; A = 16); Y (Z = 9; A = 20); T (Z = 10; A = 20); Q (Z = 8; A = 17). Các nguyên tử thuộc cùng một nguyên tố hóa học là
A. X và Y. B. X và T.
C. X và Q. D. Y và T.
Câu 4: Trong tự nhiên, nguyên tố chlorine có hai đồng vị bền, trong đó đồng vị chiếm 75,77%. Biết nguyên tử khối trung bình của chlorine là 35,48. Số khối của đồng vị còn lại là
A. 36. B. 37. C. 38. D. 39.
Câu 5: Orbital p có dạng
A. hình tròn.
B. hình số tám nổi.
C. hình cầu.
D. hình bầu dục.
Câu 6: Số electron tối đa có trong lớp M là
A. 2. B. 8. C. 18. D. 32.
Câu 7: Phân lớp d có số orbital là
A. 1. B. 3. C. 5. D. 7.
Câu 8: Cấu hình electron nguyên tử Mg (Z = 12) là
A. 1s22s22p63s2.
B. 1s22s22p43s23p2.
C. 1s22s22p53s2.
D. 1s22s22d63s2.
Câu 9: Các nguyên tố hóa học có cùng đặc điểm nào sau đây được xếp thành một cột?
A. Số electron.
B. Số electron hóa trị.
C. Số hiệu nguyên tử.
D. Số lớp electron.
Câu 10: Cho cấu hình electron nguyên tử chlorine: 1s22s22p63s23p5. Chlorine thuộc
A. nguyên tố s.
B. nguyên tố p.
C. nguyên tố d.
D. nguyên tố f.
Câu 11: Cho các nguyên tố: Al (Z = 13); P (Z = 15); S (Z = 16); O (Z = 8). Nguyên tố có bán kính nhỏ nhất là
A. P. B. Al. C. S. D. O.
Câu 12: Số electron hóa trị của nguyên tố X có Z = 20 là
A. 1. B. 2. C. 3. D. 4.
Câu 13: Nguyên tố có tính phi kim mạnh nhất là
A. F. B. Fe. C. Hg. D. Cs.
Câu 14: Trong các oxide dưới đây, acidic oxide là
A. Na2O. B. Al2O3. C. CaO. D. P2O5.
Câu 15: Lưu huỳnh (sulfur) là nguyên tố thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn. Số lớp electron của lưu huỳnh là
A. 3. B. 6. C. 16. C. 9.
Câu 16: Định luật tuần hoàn phát biểu rằng tính chất của các đơn chất cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố biến đổi tuần hoàn theo chiều tăng của
A. điện tích hạt nhân nguyên tử.
B. khối lượng nguyên tử.
C. bán kính nguyên tử.
D. số lớp electron.
Câu 17: Nguyên tố nào sau đây không phải là khí hiếm?
A. Helium.
B. Sodium.
C. Neon.
D. Argon.
Câu 18: Khi nguyên tử oxygen nhận thêm 2 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
A. F. B. He. C. Ne. D. Ar.
Câu 19: Sơ đồ tạo thành ion nào sau đây là sai?
A. Li → Li+ + 1e.
B. Be → Be2+ + 2e.
C. O + 2e → O2-.
D. Ne + 2e → Ne2-.
Câu 20: Hợp chất ion là
A. CO2. B. CaO. C. H2O. D. SO2.
Câu 21: Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là
A. liên kết ion.
B. liên kết cộng hoá trị.
C. liên kết kim loại.
D. liên kết hydrogen.
Câu 22: Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
A. 3. B. 6. C. 5. D. 4.
Câu 23: Phát biểu nào sau đây là sai?
A. Các hợp chất cộng hóa trị tồn tại ở trạng thái rắn, lỏng hoặc khí.
B. Các hợp chất cộng hóa trị không cực tan tốt trong các dung môi không cực.
C. Các hợp chất cộng hóa trị tan tốt trong nước.
D. Các hợp chất cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
Câu 24: Cho độ âm điện của C và O lần lượt là 2,55 và 3,44. Liên kết giữa C và O trong phân tử CO2 là
A. liên kết cộng hóa trị không phân cực.
B. liên kết cộng hóa trị phân cực.
C. liên kết ion.
D. liên kết hydrogen.
Câu 25: Số liên kết σ và π có trong phân tử C2H4 lần lượt là
A. 5 và 1.
B. 1 và 1.
C. 2 và 0.
D. 4 và 0.
Câu 26: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hóa trị không phân cực?
A. O2, H2, N2, H2O.
B. HI, HCl, HBr, HF.
C. MgO, Al2O3, AlCl3, Na2O.
D. Cl2, O2, N2, F2.
Câu 27: Vì sao HF có nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI?
A. HF có phân tử khối lớn nhất.
B. HF có liên kết hydrogen.
C. HF có tương tác van der Waals lớn nhất.
D. HF là hợp chất phân cực nhất.
Câu 28: Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
A. C2H6.
B. H2O.
C. CO2.
D. H2S.
Phần II: Tự luận (3 điểm)
Câu 29 (0,5 điểm): Viết cấu hình electron của nguyên tử fluorine và dự đoán khả năng nhường hay nhận electron của nguyên tố fluorine khi tham gia các phản ứng hóa học.
Câu 30 (0,5 điểm): Hãy viết công thức Lewis của phân tử O2. Xác định số electron riêng và dùng chung của nguyên tử O trong phân tử này.
Câu 31 (1 điểm): Hãy giải thích tại sao nhiệt độ sôi của H2O (100 oC) cao hơn đáng kể so với nhiệt độ sôi của H2S (-60,75 oC).
Câu 32 (1 điểm): Mô tả sự tạo thành liên kết ion trong magnesium oxide. Biết Mg (Z = 12); O (Z = 8).

