Đề thi Hóa học 10 Học kì 2 có đáp án (5 đề)
Đề thi Hóa học 10 Học kì 2 có đáp án (5 đề)
Với Đề thi Hóa học 10 Học kì 2 có đáp án (5 đề) được tổng hợp chọn lọc từ đề thi môn Hoá học 10 của các trường trên cả nước sẽ giúp học sinh có kế hoạch ôn luyện từ đó đạt điểm cao trong các bài thi Hoá học lớp 10.

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 1)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Các số oxi hóa phổ biến của Clo trong hợp chất là
A. -1, 0, +1, +3,+5,+7. B. -2, 0, +4, +6.
C. -1, +1, +3, +5, +7. D. -2, +4, +6.
Câu 2: Cho lượng dư dung dịch AgNO3 tác dụng với hỗn hợp gồm 0,2 mol KF và 0,1 mol KCl. Khối lượng kết tủa tạo thành là
A. 27,05 gam. B. 39,75 gam. C. 10,8 gam. D. 14,35 gam.
Câu 3: Clorua vôi được điều chế bằng phương pháp nào dưới đây?
A. Cho clo tác dụng với dung dịch NaOH, đun nóng.
B. Cho clo tác dụng với dung dịch NaOH ở điều kiện thường.
C. Cho clo tác dụng với nước
D. Cho clo tác dụng với Ca(OH)2 (dạng sữa vôi), ở 30ºC.
Câu 4: Khi cho O3 tác dụng lên giấy có tẩm KI và hồ tinh bột, thấy tờ giấy xuất hiện màu gì?
A.Màu vàng. B. Màu đỏ. C. Màu xanh. D. Màu tím.
Câu 5: Có thể phân biệt 3 dung dịch: NaOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
A. giấy quỳ tím. B. Zn. C. Al. D. BaCO3.
Câu 6: Để chứng minh tính oxi hóa của SO2, người ta cho SO2 phản ứng với chất nào sau đây?
A. Dung dịch brom.
B. Dung dịch kiềm.
C. Dung dịch KMnO4.
D. Dung dịch axit sunfuhiđric.
Câu 7: Cho Na2CO3 tác dụng với H2SO4 đặc, nóng, sản phẩm khí thu được là
A. CO2 và SO2. B. SO3 và CO2. C. SO2. D. CO2.
Câu 8: Cho 1,3 gam Zn và 1,6 gam Cu tác dụng với dung dịch H2SO4 loãng, dư. Sau phản ứng thu được V lít khí H2 (đktc). Giá trị của V là
A. 1,008 lít. B. 0,336 lít. C. 0,448 lít. D. 0,672 lít.
Câu 9: Phát biểu nào sau đây là không đúng?
A. Trong đời sống, ozon được dùng để sát trùng nước sinh hoạt.
B. 90% lượng lưu huỳnh được khai thác để sản xuất H2SO4.
C. Tính axit của H2SO3 < H2SO4.
D. Để phân biệt CO2 và SO2 có thể dùng Ba(OH)2 dư.
Câu 10: Cho các cân bằng sau
(I) 2HI (k) ⇔ H2 (k) + I2 (k);
(II) CaCO3 (r) ⇔ CaO (r) + CO2 (k);
(III) FeO (r) + CO (k) ⇔ Fe (r) + CO2 (k);
(IV) 2SO2 (k) + O2 (k) ⇔ 2SO3 (k);
Khi giảm áp suất của hệ, số cân bằng bị chuyển dịch theo chiều nghịch là
A. 4. B. 3. C. 2. D. 1.
II. Tự luận ( 7 điểm)
Câu 1 ( 1 điểm): Thực hiện phản ứng sau trong bình kín: CO(k) + Cl2 (k) → COCl2(k)
Lúc đầu nồng độ Cl2 là 0,08 mol/l. Sau 1 phút 20 giây, nồng độ Cl2 là 0,024 mol/l. Tính tốc độ trung bình của phản ứng tính theo Cl2 trong khoảng thời gian trên.
Câu 2 ( 2 điểm): Bằng phương pháp hóa học (không dùng chất chỉ thị) hãy phân biệt các dd sau chứa trong các lọ riêng biệt mất nhãn: CaCl2, KBr, HCl. Viết phương trình hóa học xảy ra.
Câu 3 ( 3 điểm):
1/ Dẫn từ từ 8,96 lít SO2 (ở đktc) vào 250 ml Ba(OH)2 1M. Kết thúc thí nghiệm thu được b gam chất rắn A và dung dịch B chứa c gam chất tan. Xác định b, c.
2/ Cho 5,6 lít hỗn hợp X gồm: Cl2, O2 (ở đktc, tỉ khối so với He là 13,85) phản ứng vừa đủ với 15,5 gam hỗn hợp Y gồm: Al, Cu thu được a gam chất rắn. Xác định % khối lượng các chất trong Y.
Câu 4 ( 1 điểm): Cho 3,15g hỗn hợp X gồm Mg và kim loại M (hóa trị n không đổi), tác dụng với Cl2, sau một thời gian thu được 10,25g chất rắn Y. Hòa tan hết Y trong H2SO4 loãng, sinh ra 1,12 lít khí H2 ở đktc. Mặt khác cho 0,1 mol M tác dụng với H2SO4 đặc, nóng dư thì lượng khí thoát ra không quá 2,52l ở đktc. Xác định kim loại M.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | C | D | D | C | D | D | D | C | D | D |
Câu 1: Các số oxi hóa phổ biến của Clo trong hợp chất là -1, +1, +3, +5, +7. Chọn đáp án C.
Câu 2:
KF + AgNO3 → không phản ứng
KCl + AgNO3 → AgCl + KNO3
0,1 0,1 (mol)
→m ↓ = 0,1.143,5 = 14,35 gam. Chọn đáp án D.
Câu 3: Clorua vôi được điều chế bằng cách cho clo tác dụng với Ca(OH)2 (sữa vôi) ở 30 º C. Chọn đáp án D.
Câu 4: O3 + 2KI + H2O → I2 + 2KOH + O2. I2 sinh ra làm xanh giấy tẩm hồ tinh bột. Chọn đáp án C.
Câu 5:
2HCl + BaCO3 → 2BaCl2 + CO2 ↑ + H2O
H2SO4 + BaCO3 → BaSO4↓ + CO2 ↑ + H2O
NaOH + BaCO3 → không hiện tượng. Chọn đáp án D.
Câu 6: Chọn đáp án D.
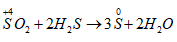
Câu 7: Na2CO3 + H2SO4 đ → Na2SO4 + CO2 + H2O. Chọn đáp án D.
Câu 8:
Cu + H2SO4 loãng → không phản ứng
Zn + H2SO4 loãng → ZnSO4 + H2
0,02 0,02 mol
→Vkhí = 0,02.22,4 = 0,448 lít. Chọn đáp án C.
Câu 9: Không thể phân biệt CO2 và SO2 bằng Ba(OH)2 dư. Chọn đáp án D.
Câu 10:
Khi giảm áp suất của hệ, cân bằng bị chuyển dịch theo chiều nghịch là:
(IV) 2SO2 (k) + O2 (k) ⇔ 2SO3 (k). Chọn đáp án D.
II. Tự luận ( 7 điểm)
Câu 1 ( 1 điểm):
Đổi 1 phút 20 giây = 80 giây. (0,5 điểm)
Áp dụng công thức:
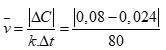
Tính được (0,5 điểm)
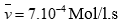
Câu 2 ( 2 điểm):
- Trích mẫu thử, đánh STT (0,5 điểm)
Dùng dd Na2CO3: (0,5 điểm)
+ Nhận ra CaCl2 nhờ kết tủa trắng (CaCO3)
+ Nhận ra HCl nhờ khí (CO2) thoát ra.
+ KBr không hiện tượng (0,5 điểm)
PTHH: (0,5 điểm)
CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O.
HS phân biệt theo cách khác, đúng cho điểm tối đa
Câu 3 ( 3 điểm):
1/ Tính số mol SO2 = 0,4 mol; số mol Ba(OH)2 0,25 mol (0,25 điểm)
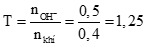
Sau phản ứng thu được 2 muối BaSO3 (x mol), Ba(HSO3)2 (y mol)
PTHH: (0,5 điểm)
SO2 + Ba(OH)2 → BaSO3 + H2O
x x x (mol)
2SO2 + Ba(OH)2 → Ba(HSO3)2
2y y y (mol)
Lập hệ phương trình: (0,5 điểm)
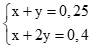
Giải hệ được x = 0,1 và y = 0,15. (0,25 điểm)
→ b = 0,1. 217 = 21,7 gam, c = 0,15.299 = 44,85 gam.
2/ Áp dụng qui tắc đường chéo hoặc lập hệ pt tìm ra số mol Cl2 = 0,15; O2 = 0,1 (0,5 điểm)
Gọi số mol của Al và Cu lần lượt là x và y (mol) (0,5 điểm)
Theo khối lượng: 27x + 64y =15,5 (1)
Theo bảo toàn e: 3.nAl + 2.nCu = 2.nCl2 + 4.nO2 → 3x + 2y = 0,7 (2)
Giải hệ được x = 0,1; y = 0,2 (0,5 điểm)
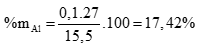
%mCu = 100 – 17,42 = 82,58%
Câu 4 ( 1 điểm):
Xét TH cho 0,1 mol M vào H2SO4 đặc (0,25 điểm)
Áp dụng bảo toàn e có số mol SO2 = 0,05.n
Theo bài ra có VSO2 < 2,52 lít → 0,05.n < 0,1125 → n > 2,25.
Mà n là hóa trị của kim loại → n = 3
Gọi số mol M là a (mol); số mol Mg là b (mol) (0,25 điểm)
Theo bài ra ta có: Ma + 24b = 3,15 (1)
Áp dụng ĐL bảo toàn khối lượng → khối lượng Clo = 10,25 – 3,15 = 7,1 gam
Theo bài ra ta có các quá trình (0,25 điểm)
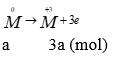
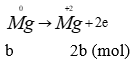
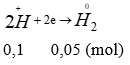
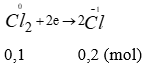
Áp dụng bảo toàn e → 3a + 2b = 0,3 (2) thế vào (1) được: (0,25 điểm)
(36 – M). a = 0,45
M có hóa trị 3, M < 36, vậy M là Al.

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 2)
I. Trắc nghiệm ( 3 điểm)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: X là nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn. Trong oxit cao nhất của X, X chiếm 38,789% về khối lượng. Nguyên tố X là?
A. F. B. Cl. C. Br. D. I.
Câu 2: Dung dịch axit nào sau đây được ứng dụng để khắc chữ lên thủy tinh?
A. HCl. B. HBr. C. HF. D. H2SO4.
Câu 3: Cho 0,515 gam muối natri halogenua tác dụng với dung dịch AgNO3 dư thu được 0,94 kết tủa. Công thức phân tử của muối là
A. NaF. B. NaCl. C. NaBr. D. NaI.
Câu 4: Nguyên tố oxi trong hợp chất nào sau đây có số oxi hóa khác với các hợp chất còn lại?
A. K2O. B. H2O2. C. H2SO3. D. NaClO3
Câu 5: Lưu huỳnh thể hiện tính khử khi tác dụng với chất nào dưới đây?
A. F2. B. Fe. C. Mg. D. H2.
Câu 6: Dẫn 2,24 lít SO2 (đktc) vào lượng dư dung dịch Ba(OH)2. Khối lượng kết tủa tạo thành sau phản ứng là
A. 29,9 gam. B. 21,7 gam. C. 20,8 gam. D. 26,2 gam.
Câu 7: Hòa tan hết 9 gam Fe(OH)2 bằng dung dịch H2SO4 đặc, nóng (dư), thu được V lít (đktc) khí SO2 (sản phẩm khử duy nhất). Giá trị của V là
A. 2,24 lít. B. 3,36 lít. C. 4,48 lít. D. 1,12 lít.
Câu 8: Dung dịch H2SO4 loãng có thể tác dụng với cả 2 chất nào sau đây?
A. Cu và CuO. B. Fe và Fe2O3.
C. C và CO2. D. S và SO2.
Câu 9: Trường hợp nào sau đây không xảy ra phản ứng hoá học?
A. Sục khí SO2 vào dung dịch H2S.
B. Sục khí H2S vào dung dịch CuCl2.
C. Sục khí H2S vào dung dịch ZnCl2.
D. Cho Fe vào dung dịch H2SO4 loãng, nguội.
Câu 10: Cho cân bằng hoá học: PCl5(k) ⇔ PCl3(k) + Cl2(k); Δ H > 0
Cân bằng chuyển dịch theo chiều thuận khi
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
C. thêm Cl2 vào hệ phản ứng.
D. tăng áp suất của hệ phản ứng.
II. Tự luận ( 7 điểm)
Câu 1 ( 1 điểm): Trong thiên nhiên H2S là khí độc được sinh ra do nhiều nguồn như: Do hợp chất hữu cơ (rau, cỏ, xác động vật ...) thối rữa mà thành; các vết nứt núi lửa; hầm lò khai thác than; … . Em hãy giải thích tại sao H2S không bị tích tụ trong khí quyển (nguyên nhân chính) và viết phương trình minh họa.
Câu 2 ( 2 điểm): Cho hỗn hợp X gồm 1,2 gam Mg và 1,35 Al phản ứng hoàn toàn với một lượng khí Cl2 dư. Kết thúc phản ứng thấy thu được m gam muối. Tính m và thể tích khí Cl2 ở đktc cần dùng để phản ứng hết với lượng kim loại trên.
Câu 3 ( 3 điểm): Nung một hỗn hợp gồm có 2,97g Al và 4,08g S trong môi trường kín không có không khí đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp chất rắn A. Cho A tác dụng với HCl dư, thu được hỗn hợp khí B.
a/ Hãy viết các PTHH xảy ra.
b/ Tính % thể tích mỗi khí trong hỗn hợp B.
Câu 4 ( 4 điểm): Một hỗn hợp A có khối lượng 5,08g gồm CuO và một oxit của sắt. Hòa tan hoàn toàn A trong dd H2SO4 đặc, nóng, dư thu được 0,168 lít khí SO2 ở điều kiện tiêu chuẩn và dung dịch B chứa 12,2 gam muối sunfat. Xác định công thức của oxit sắt và % khối lượng từng oxit trong A?
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | B | C | C | B | A | B | D | B | C | B |
Câu 1: Oxit cao nhất của X là X2O7. Ta có:
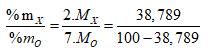
→MX = 35,5. Vậy X là Clo. Chọn đáp án B.
Câu 2: Dung dịch axit HF được ứng dụng để khắc chữ lên thủy tinh. Chọn đáp án C.
Câu 3: NaX + AgNO3 → AgX + NaNO3
Có nNaX = nAgX ⇔
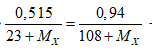
→ MX = 80. Vậy muối là NaBr. Chọn đáp án C.
Câu 4: Nguyên tố oxi trong H2O2 có số oxi hóa là -1. Chọn đáp án B.
Câu 5: Chọn đáp án A.
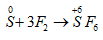
Câu 6:
SO2 + Ba(OH)2 dư → BaSO3 + H2O
0,1 0,1 (mol)
→ m ↓ = 0,1.217 = 21,7 gam. Chọn đáp án B.
Câu 7:
2Fe(OH)2 + 4H2SO4đ → Fe2(SO4)3 + SO2 +6 H2O
0,1 0,05
→Vkhí = 0,05.22,4 = 1,12 lít. Chọn đáp án D.
Câu 8: Dung dịch H2SO4 loãng có thể tác dụng với cả 2 chất Fe và Fe2O3. Chọn đáp án B.
Câu 9: H2S + ZnCl2 → không phản ứng. Chọn đáp án C.
Câu 10: Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ của hệ phản ứng. Chọn đáp án B.
II. Tự luận ( 7 điểm)
Câu 1 ( 1 điểm):
Nguyên nhân H2S không tích tụ trong khí quyển: H2S bị oxi hóa bởi O2 trong không khí ở điều kiện thường thành S không độc. (0,5 điểm)
2H2S + O2 → 2S + 2H2sO (0,5 điểm)
Câu 2 ( 2 điểm):
Tính được: Mg (0,05 mol); Al (0,05 mol) (0,5 điểm)
2Al + 3Cl2 → 2AlCl3 (0,25 điểm)
0,05 0,075 0,05 (mol)
Mg + Cl2 → MgCl2 (0,25 điểm)
0,05 0,05 0,05 (mol)
m = 0,05. 133,5 + 0,05. 95 = 11,425 gam (0,5 điểm)
V = (0,075+ 0,05).22,4 = 2,8 lít. (0,5 điểm)
Câu 3 ( 3 điểm):
Tính được nAl = 0,11 (mol), nS = 0,1275 (mol) (0,5 điểm)
PTHH:
2Al + 3S → Al2S3 (0,5 điểm)
0,11 0,1275 (mol)
Dựa vào tỉ lệ số mol xác định được chất rắn A sau phản ứng gồm: Al dư (0,025 mol); Al2S3 (0,0425 mol)
Cho A vào HCl có các phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2 (0,5 điểm)
0,025 0,0375 (mol)
Al2S3 + 6HCl → 2AlCl3 + 3H2S (0,5 điểm)
0,0425 0,1275 (mol)
Với chất khí ở cùng đk tº và p, tỉ lệ về thể tích cũng là tỉ lệ về số mol (0,5 điểm)
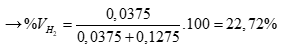
%VH2S = 100 – 22,72 = 77,28%. (0,5 điểm)
Câu 4 ( 4 điểm):
Tính được nSO2 = 0,0075mol
Gọi CuO (a mol), CT oxit sắt là FexOy (b mol)
Theo khối lượng ta có: 80a + b.(56x+16y) = 5,08 (1)
Sử dụng bảo toàn e hoặc viết PTHH: b.(3x-2y) = 0,015 (2)
Theo khối lượng muối sunfat: 160a+ 200.bx = 12,2 (3)
Giải hệ ta có a = 0,02, bx = 0,045, by = 0,06
→ x/y=3/4 nên công thức của oxit là Fe3O4
Tính được mCuO=1,6 g →
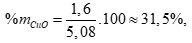
%mFe3O4 = 100 – 31,5 = 68,5%.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 3)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Đặc điểm nào sau đây không là đặc điểm chung của tất cả các halogen?
A. Liên kết trong phân tử halogen (X2) không bền lắm.
B. Các nguyên tố halogen đều có các số oxi hóa -1; +1; +3; +5; +7 trong các hợp chất.
C. Halogen là các phi kim điển hình.
D. Trong phản ứng hóa học, nguyên tử halogen dễ thu thêm 1 electron.
Câu 2: Những nguyên tố ở nhóm nào sau đây có cấu hình electron lớp ngoài cùng là ns2np5?
A. Nhóm kim loại kiềm.
B. Nhóm khí hiếm.
C.Nhóm halogen.
D. Nhóm oxi – lưu huỳnh.
Câu 3: Cho các phương trình hóa học sau:
(a) O2 + 4Ag → 2Ag2O
(b) F2 + 2NaCl → 2NaF + Cl2
(c) H2S + FeCl2 → FeS + 2HCl
(d) HCl + AgNO3 → AgCl + HNO3
Số phương trình hóa học viết đúng là
A. 4. B. 1. C. 2. D. 3.
Câu 4: Trong PTN oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
A. CaCO3. B. KMnO4. C. BaSO4. D. Na2O.
Câu 5: Các số oxi hóa phổ biến của S trong hợp chất là
A. -2, 0, +2, +4. B. -2, 0, +4, +6.
C. -2, +2, +4. D. -2, +4, +6.
Câu 6: Dãy các muối sunfua tan trong nước là
A. CuS; FeS; ZnS. B. PbS; Ag2S; K2S.
C. FeS; ZnS; Na2S. D. BaS; K2S; Na2S.
Câu 7: Chất khí X tan trong nước tạo ra một dung dịch làm chuyển màu quỳ tím thành đỏ và có thể được dùng làm chất tẩy màu. Khí X là
A. NH3. B. CO2. C. SO2. D. O3.
Câu 8: Kim loại nào sau đây không tác dụng với dd H2SO4 loãng và dd HCl?
A. Na. B. Al. C. Mg. D. Cu.
Câu 9: Phản ứng nào sau đây là sai?
A. 2Fe(OH)2 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 6H2O.
B. Fe2O3 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O.
C. Fe(OH)2 + H2SO4 loãng → FeSO4 + 2H2O .
D. Fe2O3 + 3H2SO4 loãng → Fe2(SO4)3 + 3H2O.
Câu 10: Cho cân bằng hoá học: N2 (k) + 3H2 (k) ⇔ 2NH3 (k); phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
A. thay đổi áp suất của hệ.
B. thay đổi nồng độ N2.
C. thay đổi nhiệt độ.
D. thêm chất xúc tác Fe.
II. Tự luận ( 7 điểm)
Câu 1 ( 1 điểm): Cho phản ứng sau : HCOOH + Br2 → 2HBr + CO2
Lúc đầu nồng độ hơi Br2 0,04 mol/l. Sau 100 giây, nồng độ hơi Br2 còn lại là 0,012 mol/l. Tính tốc độ trung bình của phản ứng theo Br2 trong khoảng thời gian 100 giây?
Câu 2 ( 2 điểm): Sục từ từ 2,24 lít SO2 (ở đktc) vào 200ml dung dịch KOH 0,85M thu được m gam muối. Tính m?
Câu 3 ( 2 điểm): Cho 4,65 gam hỗn hợp A gồm MgX2 và MgY2 (X, Y là 2 nguyên tố halogen ở 2 chu kỳ kế tiếp, MX < MY) phản ứng hoàn toàn với dd AgNO3 dư, thu được 11,05 gam kết tủa. Xác định hai nguyên tố X, Y và tính khối lượng mỗi muối trong hỗn hợp A?
Câu 4 ( 2 điểm): Cho 15,7 gam hỗn hợp X gồm: Na2CO3, Al2O3 vào 100g dung dịch H2SO4 a% dư đến phản ứng hoàn toàn thu được dung dịch X chứa và 2,24 lít khí Y (ở đktc).
a. Xác định % khối lượng của từng chất trong X?
b. Trung hòa X cần 100 ml NaOH 0,5M. Xác định a?
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | B | C | B | B | D | D | C | D | B | D |
Câu 1: F chỉ có số o xi hóa -1 trong các hợp chất. Chọn đáp án B.
Câu 2: Các nguyên tố ở nhóm halogen có cấu hình electron lớp ngoài cùng là ns2np5. Chọn đáp án C.
Câu 3: Phương trình hóa học viết đúng là: (d) HCl + AgNO3 → AgCl + HNO3. Chọn đáp án B.
Câu 4: Trong PTN oxi có thể thu được từ phản ứng nhiệt phân KMnO4. Chọn đáp án B.
Câu 5: Các số oxi hóa phổ biến của S trong hợp chất là -2, +4, +6. Chọn đáp án D.
Câu 6: Các muối sunfua BaS; K2S; Na2S tan trong nước. Chọn đáp án D.
Câu 7: Khí SO2 tan trong nước tạo ra dung dịch làm chuyển màu quỳ tím thành đỏ và có thể được dùng làm chất tẩy màu.Chọn đáp án C.
Câu 8: Cu không tác dụng với dd H2SO4 loãng và dd HCl. Chọn đáp án D.
Câu 9: Phản ứng sai là: Fe2O3 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O. Chọn đáp án B.
Câu 10: Cân bằng hoá học không bị chuyển dịch khi thêm chất xúc tác Fe. Chọn đáp án D.
II. Tự luận ( 7 điểm)
Câu 1 ( 1 điểm):
Áp dụng công thức: (0,5 điểm)
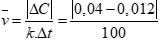
Tính được (0,5 điểm)
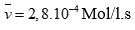
Câu 2 ( 2 điểm):
Tính được: nSO2 = 0,1mol, nKOH = 0,17mol (0,25 điểm)
Đặt: (0,25 điểm)
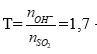
→ sau pư tạo 2 muối KHSO3 (x mol), K2SO3 (y mol)
SO2 + KOH → KHSO3 (0,25 điểm)
x x x (mol)
SO2 + 2KOH → K2SO3 + H2O (0,25 điểm)
y 2y y (mol)
Lập hệ: (0,25 điểm)
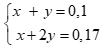
Giải hệ được: x = 0,03, y = 0,07 (0,25 điểm)
→ m = mKHSO3 + mK2SO3 = 14,66 gam. (0,25 điểm)
Câu 3 ( 2 điểm):
TH1: X là F và Y là Cl. Tính được nAgCl ~ 0,077 mol. (0,5 điểm)
PTHH: MgCl2 + 2AgNO3→2AgCl + Mg(NO3)2
0,0385 ← 0,077 (mol)
⇒mMgCl2 = 0,0385. 95 = 3,6575 (0,5 điểm)
⇒mMgF2 = 0,9925g (thỏa mãn)
TH2: X khác F gọi X, Y là R (điều kiện: 35,5 < MR < 127). Ta có PTHH: (0,5 điểm)
MgR2 + 2AgNO3 → 2AgR + Mg(NO3)2
nMgR2=
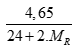
nAgR=
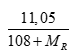
Có nAgR= 2nMgR2⇒
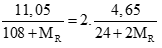
⇒MR = 57,75
⇒ X là Cl; Y là Br
Câu 4 ( 2 điểm):
Tính được số mol CO2 bằng 0,1.
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
0,1 0,1 0,1 (mol)
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
0,05 0,15
→ m Na2CO3 = 106.0,1 = 10,6g
→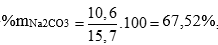
%m Al2O3 = 100 – 67,52 = 32,48%
Tính được nAl2O3 = 0,05
Dựa vào PTHH tính đc nH2SO4 phản ứng = 0,25 mol
Phản ứng trung hòa X:
2NaOH + H2SO4 dư → Na2SO4 + 2H2O
0,05 0,025
Tổng nH2SO4 = 0,275 mol
mH2SO4=26,95g → a=26,95%

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 4)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Các halogen có tính chất hóa học cơ bản là
A. vừa có tính oxi hóa, vừa có tính khử.
B. tính khử.
C. tính kim loại.
D. tính oxi hóa.
Câu 2: Cho 0,1 mol KMnO4 tác dụng với dung dịch HCl dư, đun nóng. Khối lượng khí thoát ra là:
A.7,1 gam. B. 17,75 gam. C. 14,2 gam. D. 21,6 gam.
Câu 3: Khi cho dd AgNO3 phản ứng với dung dịch nào sau đây sẽ không cho kết tủa?
A. Dung dịch NaI. B. Dung dịch NaCl.
C. Dung dịch NaBr. D. Dung dịch NaF.
Câu 4: Khối lượng của 3,36 lít khí O2 ở điều kiện tiêu chuẩn là
A. 4,8 gam. B. 3,2 gam. C. 6,4 gam. D. 2,4 gam.
Câu 5: Cho 2,8 gam sắt tác dụng với 0,32 gam lưu huỳnh sản phẩm thu được sau khi phản ứng xảy ra hoàn toàn là
A. FeS. B. FeS và S.
C. FeS và Fe D. FeS, Fe và S.
Câu 6: Thuốc thử nào sau đây dùng để phân biệt CO2 và SO2?
A. nước brom. B. CaO.
C. dung dịch Ba(OH)2. D. dung dịch NaOH.
Câu 7: Dung dịch H2SO4 loãng và dung dịch HCl phản ứng được với tất cả các chất trong dãy nào sau đây?
A. Al2O3, Ba(OH)2, BaCl2.
B. CuO, NaCl, CuS.
C. BaCl2, Na2CO3, FeS.
D. BaSO3, Na2CO3, FeS.
Câu 8: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là
A. ns2np4. B. ns2np5.
C. ns2np3. D. (n-1)d10ns2np4.
Câu 9: Khi cho Al vào các axit sau, trường hợp nào không xảy ra phản ứng?
A. HCl. B. H2SO4 đặc, nóng.
C. H2SO4 loãng. D. H2SO4 đặc, nguội.
Câu 10: Cho cân bằng (trong bình kín) sau :
CO(k) + H2O(k)⇔CO2+H2(k) ΔH<0
Trong các yếu tố : (1) tăng nhiệt độ; (2) thêm một lượng hơi nước; (3) thêm một lượng H2; (4) tăng áp suất chung của hệ; (5) dùng chất xúc tác.
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là
A. (1), (4), (5). B. (1), (2), (4). C. (1), (2), (3). D. (2), (3), (4).
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Bằng phương pháp hóa học (Không dùng chất chỉ thị) hãy phân biệt 3 chất sau: KCl; H2SO4; K2SO4 đựng trong các lọ mất nhãn.
Câu 2 ( 1 điểm): Thực hiện phản ứng sau trong bình kín: H2 (k) + Br2 (k) → 2HBr (k). Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tính tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên.
Câu 3 ( 2 điểm): Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Zn vào một lượng vừa đủ dung dịch HCl loãng có thể tích 100ml. Sau phản ứng thu được 1,12 lít H2 (đktc) và dung dịch X.
a/ Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp.
b/ Tính nồng độ chất tan các muối thu được sau phản ứng. Coi thể tích dung dịch thay đổi không đáng kể sau phản ứng.
Câu 4 ( 2 điểm): Hoà tan hỗn hợp bột gồm m gam Cu và 4,64 gam Fe3O4 vào dung dịch H2SO4 (loãng, rất dư), sau khi các phản ứng kết thúc chỉ thu được dung dịch X. Dung dịch X làm mất màu vừa đủ 100 ml dung dịch KMnO4 0,1M. Tính giá trị của m.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | D | B | D | A | C | A | D | B | D | C |
Câu 1: Các halogen có tính chất hóa học cơ bản là tính oxi hóa. Chọn đáp án D.
Câu 2: Áp dụng ĐL bảo toàn e có 5.nKMnO4 = 2.nClo → nClo = 0,25 mol → m.nClo = 0,25.71 = 17,75g. Chọn đáp án B.
Câu 3: AgNO3 + NaF → không phản ứng. Chọn đáp án D.
Câu 4: nkhí = 0,15 mol → mkhí = 0,15.32 = 4,8 gam. Chọn đáp án A.
Câu 5:
Fe + S → FeS
0,05 0,01
→ Sau phản ứng thu được Fe dư và FeS. Chọn đáp án C.
Câu 6: Có thể dùng nước brom để phân biệt CO2 và SO2. Chọn đáp án A.
Câu 7: BaSO3, Na2CO3, FeS đều phản ứng với dd H2SO4 loãng và dd HCl. Chọn đáp án D.
Câu 8: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là ns2np5. Chọn đáp án B.
Câu 9: Al + HSO4 đặc, nguội → không phản ứng. Chọn đáp án D.
Câu 10: Các yếu tố làm thay đổi cân bằng của hệ là: (1) tăng nhiệt độ; (2) thêm một lượng hơi nước; (3) thêm một lượng H2. Chọn đáp án C
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
-Đánh số thứ tự từng lọ, trích mẫu thử (0,5 điểm)
-Dùng dd BaCl2 nhận ra H2SO4 và K2SO4 do tạo kết tủa trắng. Không hiện tượng: KCl (0,5 điểm)
PTHH:
BaCl2 + H2SO4 BaSO4 + 2HCl
BaCl2 + K2SO4 BaSO4 + 2KCl
Lưu ý: HS dùng AgNO3 ngay từ đầu không cho điểm vì Ag2SO4 ít tan
-Dùng dd Na2CO3 nhận ra H2SO4 do có hiện tượng sủi bọt khí (0,5 điểm)
Na2CO3 + H2SO4 Na2SO4 + CO2 + H2O
Không hiện tượng: K2SO4
Câu 2 ( 1 điểm):
Đổi 2 phút = 120 giây. (0,5 điểm)
Áp dụng công thức:
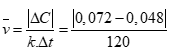
Tính được (0,5 điểm)
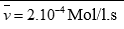
Câu 3 ( 2 điểm):
Mg + 2HCl → MgCl2 + H2 (0,25 điểm)
x x (mol)
Zn + 2HCl → ZnCl2 + H2 (0,25 điểm)
y y (mol)
Tính được số mol khí H2 = 0,05 mol, gọi số mol Mg và Zn lần lượt là x, y
Lập hệ:
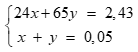
Giải hệ được x = 0,02 mol; y = 0,03 mol (0,25 điểm)
→%mMg =
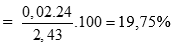
%mZn = 100 – 19,75 = 80,25%
Tính nMgCl2 = 0,02; nZnCl2 = 0,03 (0,25 điểm)
Coi thể tích dung dịch thay đổi không đáng kể sau phản ứng.
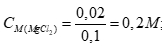
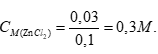
Câu 4 ( 2 điểm):
Chỉ thu được dung dịch X → Cu tan hết. (0,5 điểm)
PTHH:
Fe3O4 + 4H2SO4 → Fe2(SO4)3 + FeSO4 + 4H2O (0,25 điểm)
0,02 0,02 0,02 (mol)
Cu + Fe2(SO4)3 → 2FeSO4 + CuSO4 (0,25 điểm)
x x 2x (mol)
→nFeSO4 = 2x + 0,02 mol (0,5 điểm)
Áp dụng định luật bảo toàn e có: nFeSO4 = 5.nKMnO4
→ 2x + 0,02 = 0,05 → x = 0,015
m = 0,015.64 = 0,96g (0,5 điểm)
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 5)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Cl2 không phản ứng trực tiếp được với chất nào sau đây?
A. O2. B. H2. C. Cu. D. NaOH.
Câu 2: Trong các halogen sau, halogen nào có tính khử yếu nhất?
A. Flo. B. Clo. C. Brom. D. Iot.
Câu 3: Cho 4,35 gam MnO2 tác dụng với lượng dư dung dịch HCl đặc, đun nóng. Thể tích khí thoát ra (ở đktc) là
A. 0,56 lít. B. 1,12 lít. C. 2,24 lít. D. 0,112 lít.
Câu 4: Nguyên tố lưu huỳnh không có khả năng thể hiện số oxi hóa là
A. +4. B. +6. C. 0. D. +5.
Câu 5: Chất nào sau đây không tác dụng với dung dịch HCl, H2SO4 loãng?
A. CuO. B. NaOH. C. Fe. D. Ag.
Câu 6: Trong phòng thí nghiệm, người ta thường điều chế oxi bằng cách
A. nhiệt phân KMnO4.
B. nhiệt phân K2MnO4.
C. điện phân nước.
D. chưng cất phân đoạn không khí lỏng
Câu 7: Dẫn 2,24 lít SO2 (đktc) vào dung dịch nước vôi trong, dư. Khối lượng kết tủa tạo thành sau phản ứng là
A. 10 gam. B. 11 gam. C. 12 gam. D. 13 gam.
Câu 8: Trường hợp nào tác dụng với H2SO4 đặc nóng và H2SO4 loãng đều cho sản phẩm giống nhau?
A. Fe. B. Fe(OH)2. C. Fe(OH)3. D. Fe3O4.
Câu 9: Hòa tan hoàn toàn 0,65 gam Zn bằng dung dịch H2SO4 đặc, nóng, dư thấy thu được V lít SO2 (đktc). Giá trị của V là
A. 0,224. B. 0,336. C. 0,112. D. 0,448.
Câu 10: Cho cân bằng hóa học: 2SO2 (k) + O2 (k)⇔2SO3 (k); phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu đúng là
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết các phương trình phản ứng xảy ra trong các trường hợp sau:
1/ Cho Cl2 tác dụng với KOH ở nhiệt độ 90ºC.
2/ Cho S tác dụng với O2
3/ Cho dd HCl tác dụng với KOH
4/ Cho FeO tác dụng với H2SO4 đặc.
Câu 2 ( 1 điểm): ): Cho phản ứng: Br2 + HCOOH → 2HBr + CO2. Nồng độ ban đầu của Br2 là 0,012 mol/lít, sau 50 giây nồng độ Br2 còn lại là a mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol/(l.s). Tính giá trị của a.
Câu 3( 2 điểm): Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch HCl 10%, thu được 2,24 lít khí H2 (ở đktc).
a/ Xác định % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b/ Tính nồng độ % các muối có trong dung dịch sau phản ứng.
Câu 4 ( 2 điểm): Hoà tan hoàn toàn 2,44 gam hỗn hợp bột X gồm FexOy và Cu bằng dung dịch H2SO4 đặc nóng (dư). Sau phản ứng thu được 0,504 lít khí SO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch chứa 6,6 gam hỗn hợp muối sunfat. Tính phần trăm khối lượng của Cu trong X.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | A | A | B | D | D | A | C | C | A | B |
Câu 1: Cl2 không phản ứng trực tiếp được với O2. Chọn đáp án A.
Câu 2: Halogen có tính khử yếu nhất là Flo. Chọn đáp án A.
Câu 3:
MnO2 + 4HCl → MnCl2 + Cl2 + H2O
0,05 0,05 (mol)
→ V = 0,05.22,4 = 1,12 lít. Chọn đáp án B.
Câu 4: Nguyên tố S không có khả năng thể hiện số oxi hóa là +5. Chọn đáp án D.
Câu 5: Ag không tác dụng với dung dịch HCl, H2SO4 loãng. Chọn đáp án D.
Câu 6: Trong phòng thí nghiệm, người ta thường điều chế oxi bằng cách nhiệt phân KMnO4. Chọn đáp án A.
Câu 7:
SO2 + Ca(OH)2 dư → CaSO3 + H2O
0,1 0,1 (mol)
→ m ↓ = 0,1. 120 = 12 gam. Chọn đáp án C.
Câu 8:
2Fe(OH)3 + 3H2SO4 loãng → Fe2(SO4)3 + 6H2O
2Fe(OH)3 + 3H2SO4 đặc → Fe2(SO4)3 + 6H2O. Chọn đáp án C
Câu 9: Áp dụng định luật bảo toàn e có nkhí = nZn = 0,01 → Vkhí = 0,01.22,4 = 0,224 lít. Chọn đáp án A.
Câu 10: Phát biểu đúng là: Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2. Chọn đáp án B.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng mỗi PT 0,5 điểm, thiếu cân bằng trừ 1/2 số điểm mỗi PT
1/ 3Cl2 + 6KOH →(90ºC) 5KCl + KClO3 + 3H2O
2/ S + O2 → SO2
3/ HCl + KOH → KCl + H2O
4/ 2FeO + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O
Câu 2 ( 1 điểm):
Áp dụng công thức: (0,5 điểm)
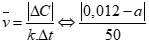
=4.10-5
Giải PT được a = 0,01 (thỏa mãn) hoặc a = 0,014 > 0,012 (loại) (0,5 điểm)
Câu 3 ( 3 điểm):
2Al + 6HCl → 2AlCl3 + 3H2 (0,25 điểm)
x 1,5x (mol)
Zn + 2HCl → ZnCl2 + H2 (0,25 điểm)
y y (mol)
Tính mol khí H2 = 0,1 mol, gọi số mol Al và Zn lần lượt là x, y (0,25 điểm)
Lập hệ:(0,25 điểm)
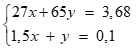
Giải hệ được x = 0,04 mol; y = 0,04 mol
tính %mAl =
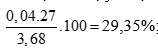
%mZn = 100 – 29,35 = 70,65%
Tính được số mol HCl = 0,2 mol; mdd HCl = 73 (gam) (0,25 điểm)
→ m dd sau pư = m dd HCl + m kim loại – mkhí = 3,68 + 73 – 0,2 = 76,48 gam
C%AlCl3 = (0,25 điểm)
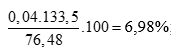
C%ZnCl2 =
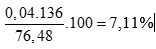
Câu 4 ( 2 điểm):
Tính được số mol SO2 bằng 0,0225 mol. (0,25 điểm)
Quy đổi hỗn hợp ban đầu thành: Fe, Cu và O2.
Khối lượng X bằng 2,44g → 56x + 64y + 32z = 2,44 (1) (0,25 điểm)
Ta có các quá trình: (0,25 điểm)
Fe → Fe3+ + 3e
x 3x (mol)
Cu → Cu2+ + 2e
y 2y (mol)
O2 + 4e → 2O2-
z 4z (mol)
S+6 + 2e→ S+4
0,045 0,0225 (mol)
→ 3x + 2y = 4z + 0,045 (2) (0,25 điểm)
mmuối = 6,6 gam → 200x + 160y = 6,6 (3) (0,25 điểm)
Giải hệ được: x = 0,025; y = 0,01; z = 0,0125 (0,25 điểm)
→ %mCu = 26,23% . (0,25 điểm)

