Đề thi Hóa Học lớp 10 Giữa học kì 1 năm 2023 tải nhiều nhất (20 đề)
Đề thi Hóa Học lớp 10 Giữa học kì 1 năm 2023 tải nhiều nhất (20 đề)
Haylamdo biên soạn và sưu tầm Đề thi Hóa Học lớp 10 Giữa học kì 1 năm 2023 tải nhiều nhất (20 đề) được tổng hợp chọn lọc từ đề thi môn Hoá học 10 của các trường trên cả nước sẽ giúp học sinh có kế hoạch ôn luyện từ đó đạt điểm cao trong các bài thi Hoá học lớp 10.

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2023
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
I. PHẦN TRẮC NGHIỆM (5 ĐIỂM)
Câu 1: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. Electron và nơtron. B. Proton và nơtron
C. Proton và electron. D. Electron, proton và nơtron.
Câu 2: Trong nguyên tử hạt mang điện
A. Chỉ có hạt proton. B. chỉ có hạt electron.
C. gồm nơtron và electron D. gồm electron và proton.
Câu 3: Nguyên tử của nguyên tố R có 56 electron và 81 nơtron. Kí hiệu nguyên tử nào sau đây là của nguyên tố R ?
A. 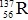 B.
B.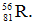 C.
C.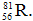 D.
D.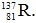
Câu 4: Đồng vị là những
A. hợp chất có cùng điện tích hạt nhân.
B. nguyên tố có cùng điện tích hạt nhân.
C. nguyên tố có cùng số khối A.
D. nguyên tử có cùng số proton nhưng khác nhau về nơtron.
Câu 5: Kí hiệu nguyên tửcho ta biết những gì về nguyên tố hoá học X?
A. Chỉ biết số hiệu nguyên tử
B. Chỉ biết số khối của nguyên tử
C. Chỉ biết khối lượng nguyên tử trung bình
D. Biết số proton, số nơtron, số electron, số khối
Câu 6: Nguyên tử của nguyên tố X có tổng các loại hạt là 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Số khối của X là:
A. 56 B. 40
C. 64 D. 39
Câu 7: Đồng trong tự nhiên có 2 đồng vị là 65Cu và 63Cu. Nguyên tử khối trung bình của đồng là 63,54. Thành phần % theo khối lượng của 63Cu trong CuCl2 là giá trị nào? (Biết MCl= 35,5)
A. 73% B. 27%
C. 33,32% D. 34,18%
Câu 8: Phân lớp 2s chứa tối đa
A. 6 electron B. 2 electron C. 10 electron D. 8 electron
Câu 9: Lớp L có số phân lớp electron là:
A. 1 B. 2 C. 3 D. 4
Câu 10: Các electron của nguyên tử nguyên tố X được phân bố trên 2 lớp, lớp thứ hai 6 có electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6 B. 8 C. 10 D. 12
Câu 11: Nguyên tử có số electron là 13 thì cấu hình electron lớp ngoài cùng là:
A. 3s2 3p2 B. 3s2 3p1
C. 2s2 2p1 D. 3p1 4s2
Câu 12: Các nguyên tố xếp ở chu kì 3 có số lớp electron trong nguyên tử là
A. 3. B. 4. C. 5. D. 6.
Câu 13: Nguyên tố Na (Z = 11) thuộc nhóm
A. IA. B. IB. C. IIA. D. IIB.
Câu 14: Nguyên tố Cu có Z = 29. Vị trí của Cu trong bảng tuần hoàn là
A. chu kì 4, nhóm IA B. chu kì 4, nhóm VIIIB
C. chu kì 4, nhóm IB D. chu kì 4, nhóm VIIIA
Câu 15: X và Y là 2 nguyên tố liên tiếp nhau trong một chu kì (ZX < ZY). Biết tổng số proton của X và Y là 31. Tên của Y là
A. Flo (Z=9) B. Oxi (Z=8) C. Photpho (Z=15) D. Lưu huỳnh (Z=16)
Câu 16: Nhóm IA trong bảng tuần hoàn có tên gọi là:
A. Nhóm kim loại kiềm. B. Nhóm kim loại kiềm thổ.
C. Nhóm halogen. D. Nhóm khí hiếm.
Câu 17: Hòa tan hoàn toàn 3,6 gam kim loại M (chưa rõ hóa trị) vào 150 gam dung dịch H2SO4 19,6% thu được dung dịch X. Để trung hòa lượng axit còn dư trong dung dịch X cần dùng 300mL dung dịch NaOH 1M. Xác định tên kim loại M?
A. K. B. Mg. C. Ca. D. Na.
Câu 18: Công thức oxit cao nhất của nguyên tố R là R2O5. Trong đó, oxi chiếm 74,07% về khối lượng. Nguyên tố R là
A. S. B. As. C. N. D. P.
Câu 19: Hòa tan hoàn toàn một lượng kim loại Ba với lượng nước dư, thu được dung dịch X và 3,36 lít H2(đktc). Thể tích dung dịch axit H2SO42M cần dùng để trung hoà dung dịch X là
A. 60mL. B. 150mL. C. 30mL. D. 75mL.
Câu 20: Trong phân tử MX2, tổng số hạt cơ bản là 140 và số hạt mang điện nhiều hơn số hạt không mang điện là 44. Số khối của X lớn hơn số khối của M là 11. Tổng số hạt cơ bản trong X nhiều hơn trong M là 16 hạt. Công thức phân tử MX2 là
A. CaCl2. B. FeS2. C. MgCl2. D. CaF2.
I. PHẦN TỰ LUẬN (5 ĐIỂM)
Câu 1 (1,5 điểm). Nguyên tử Na có 11 electron và hạt nhân có 12 nơtron, hãy trả lời các câu hỏi sau (không cần giải thích)
a. Cấu hình electron của Na là?
b. Kí hiệu của nguyên tử Na trên là?
c. Na nguyên tố kim loại, phi kim hay khí hiếm?
Câu 2 (2 điểm). Nguyên tử Clo có cấu hình electron thu gọn là [Ne]3s23p5. Hãy trả lời các câu hỏi sau (không cần giải thích)
a. Clo nằm ở Chu kỳ………………..., Nhóm …………………….. (0,5 điểm)
b. Hóa trị cao nhất của Clo với oxi là:…………………………….. (0,25 điểm)
c. Hóa trị trong hợp chất khí với hidro của Clo là: ……………….. (0,25 điểm)
d. Công thức oxit cao nhất của Clo là: ……………………………. (0,25 điểm)
e. Công thức hợp chất khí với Hidro của Clo là: …………………. (0,25 điểm)
g. So sánh tính phi kim của Clo với Flo và Brom trong cùng nhóm? ……………………… (0,5 điểm)
Câu 3 (1 điểm). Đốt cháy hoàn toàn 2,3 gam Natri trong bình đựng khí Clo. Viết phương trình phản ứng và tính khối lượng muối NaCl thu được?
Câu 4 (0,5 điểm). Hòa tan hoàn toàn 0,837 gam hỗn hợp hai kim loại X, Y ở 2 chu kì liên tiếp và thuộc nhóm IA trong nước (dư), thấy thoát ra 0,3024 lít khí H2 (đktc). Xác hai định kim loại kiềm ?

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2023
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
Cho: Na = 23, O = 16, C = 12, H = 1, Cu = 64, Fe = 56, S = 32, Br = 80
Khoanh tròn vào chữ cái đặt trước câu trả lời đúng nhất (0,4 điểm/ câu)
Câu 1: Trong nguyên tử hạt nào vào điện tích dương?
A. Electron
B. Nơtron
C. Proton
D. Nơtron và Proton
Câu 2. Nguyên tử của nguyên tố X (Z = 13) có cấu hình electron là:
A. 1s22s22p63s2
B. 1s22s22p63s13p2
C. 1s22s22p63s23p1
D. 1s22s22p53s23p1
Câu 3. Nguyên tử của nguyên tố X có tổng các hạt cơ bản là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 1. Số proton trong nguyên tử X là
A. 17 B. 18 C. 19 D. 16
Câu 4. Số phân lớp tối đa trên lớp M là
A. 2 B. 18 C. 3 D. 8
Câu 5. Nguyên tử 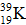 có:
có:
A. 19p, 20n, 19e B. 20p, 19n, 20e
C. 19p, 20n, 20e D. 20p, 20n, 19e
Câu 6. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử
A. Tăng dần B. Giảm dần
C. Không tăng, không giảm D. Vừa tăng, vừa giảm
Câu 7. Những nguyên tử nào sau đây là cùng một nguyên tố hóa học:
A. 17X và 18Y. B. 15X và 14Y.
C. 8X và 8Y D. 10X và 9Y.
Câu 8. Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s2. X thuộc loại nguyên tố.
A. s B. d C. f D. p
Câu 9. Nguyên tử của nguyên tố A có 56 electron, trong hạt nhân có 81 nơtron. Kí hiệu của nguyên tử nguyên tố A là
A.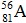 B.
B. 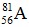 C.
C. 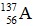 D.
D. 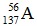
Câu 10. Cation R2+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Vị trí của R trong bảng tuần hoàn là:
A. Chu kì 2, nhóm VIB
B. Chu kì 3, nhóm IIA
C. Chu kì 2, nhóm VIIIA
D. Chu kì 2, nhóm VIA
Câu 11. Trong tự nhiên, oxi có 3 đồng vị là 16O, 17O, 18O. Có bao nhiêu loại phân tử O2?
A. 3. B. 6. C. 9. D. 12.
Câu 12. Trong tự nhiên tìm được hai đồng vị của nguyên tố X. Khảo sát cho thấy cứ 100 nguyên tử của X thì có 73 nguyên tử 63X. Biết rằng nguyên tử khối trung bình của X là 63,546, số khối của đồng vị còn lại là
A. 64 B. 65 C. 66 D. 67
Câu 13. Nguyên tố X thuộc nhóm VIA. Số electron lớp ngoài cùng của nguyên tử nguyên tố X là
A. 4 B. 5 C. 3 D. 6
Câu 14. Nguyên tử nào sau đây có 4 electron thuộc lớp ngoài cùng?
A. 13Al B. 8O C.11Na D. 6C
Câu 15. Nguyên tố X thuộc chu kì 3 nhóm IVA. Cấu hình electron của nguyên tử X là
A. 1s22s22p53s23p1
B. 1s22s22p53s23p2
C. 1s22s22p53s23p3
D. 1s22s22p53s23p4
Câu 16. Trong tự nhiên, đồng có 2 đồng vị 63Cu và 65Cu, trong đó đồng vị 65Cu chiếm khoảng 27% về số nguyên tử. Phần trăm khối lượng của 63Cu trong CuCl2
A. 34,32% B. 34,18% C.73,00% D. 13,04%
Câu 17. Nguyên tử X có số thứ tự là 16, vị trí của nguyên tố X trong bảng tuần hoàn là?
A. Chu kỳ 2, nhóm IIA
B. Chu kỳ 3, nhóm IIIA
C. Chu kỳ 3, nhóm VIA
D. Chu kỳ 3, nhóm IVA
Câu 18. Hợp chất A được tạo thành từ cation X+ và anion Y2-. Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X+ là 11, tổng số electron trong Y2- là 50. Biết rằng hai nguyên tố trong Y2- đều thuộc cùng một nhóm A và thuộc hai chu kì liên tiếp. Phân tử khối của A là
A. 96 B. 78 C. 114 D. 132
Câu 19. Cho 11,2 gam Fe vào dung dịch HCl dư. Tính thể tích khí H2 (đktc) thu được sau phản ứng
A. 2,24 B. 4,48 C. 3,36 D. 1,12
Câu 20. Biết nguyên tử Na có kí hiệu nguyên tử là , vậy tổng số hạt p, n, e trong ion Na+ là:
A.33 B. 34 C. 35 D. 45
Câu 21. Bán kính của nguyên tử Cl, F, Br, I được sắp xếp theo chiều giảm dần là
A. Br < I < Cl < F B. F < Cl < Br < I
C. Cl < F < Br < I D. I < Br < Cl < F
Câu 22. Dãy nguyên tố nào sau đây được sắp xếp theo chiều tăng dần độ âm điện?
A. Li, Na, C, O, F
B. Na, Li, F, C, O
C. Na, Li, C, O, F
D. Li, Na, F, C, O
Câu 23. Một nguyên tử X có 26 electron. Khi mất 2 electron, cấu hình electron của ion X2+ là
A. [Ar]3d44s2
B. [Ar]3d54s1
C. [Ar]3d6
D. [Ar]3d5
Câu 24. Hợp chất khí của nguyên tố R với hidro có công thức hóa học RH4. Trong oxit mà R có hóa trị cao nhất, R chiếm 46,67% về khối lượng. Nguyên tố R thuộc chu kì
A. 2 B. 3 C. 4 D. 5
Câu 25. Nguyên tử của nguyên tố hóa học trong cùng nhóm IIA có cùng:
A. Nguyên tử khối
B. Số lớp electron
C. Cấu hình electron lớp ngoài cùng
D. Bán kính nguyên tử
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2023
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
Cho: Na = 23, O = 16, C = 12, H = 1, Cu = 64, Fe = 56, S = 32, Br = 80
Khoanh tròn vào chữ cái đặt trước câu trả lời đúng nhất (0,4 điểm)
Câu 1. Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và proton
B. proton và nơtron
C. nơtron và electron
D. electron, proton và nơtron
Câu 2. Các đồng vị của cùng một nguyên tố hóa học được phân biệt bởi:
A. Số nơtron. B. Số proton.
C. Số electron hóa trị. D. Số lớp electron.
Câu 3. Định nghĩa nào sau đây về nguyên tố hóa học là đúng?
Nguyên tố hóa học là tập hợp các nguyên tử:
A. Có cùng điện tích hạt nhân.
B. Có Cùng nguyên tử khối.
C. Có cùng số khối.
D. Có cùng số nơtron trong hạt nhân.
Câu 4. Tổng số hạt cơ bản của một nguyên tử X là 26. Số hạt mang điện nhiều hơn số hạt không mang điện là 6. Nguyên tử X là:
A. O. B. Ne. C. C. D. N.
Câu 5. Phân lớp 3d có nhiều nhất là
A. 6 electron. B. 18 electron. C. 10 electron. D. 14 electron.
Câu 6. Một nguyên tử X có tổng số hạt electron ở các phân lớp s là 6 và tổng số electron lớp ngoài cùng là 6. Cho biết X thuộc về nguyên tố hóa học nào?
A. Oxi (Z = 8) B. Lưu huỳnh (Z = 16)
C. Flo (Z = 9) D. Clo (Z = 17)
Câu 7. Nguyên tử khối trung bình của Cu là 63,546. Đồng tồn tại trong tự nhiên với 2 loại đồng vị là 65Cu và 63Cu. Thành phần phần trăm về nguyên tử của là:
A. 27,30% B. 72,7% C. 23,70% D. 26,30%
Câu 8. Trong cấu hình electron của 11Na có bao nhiêu phân lớp?
A. 2 B. 3 C. 4 D. 5
Câu 9. Một nguyên tử X có 16 electron trong lớp vỏ. Vậy cấu hình electron của X có bao nhiêu lớp?
A. 3 B. 2 C. 4 D. 5
Câu 10. Cấu hình electron của nguyên tử lưu huỳnh (Z = 17)
A. 1s22s22p53s23p4
B. 1s22s22p53s23p5
C. 1s22s22p53s23p3
D. 1s22s22p53s23p6
Câu 11. Nguyên tố Z = 19 thuộc loại nguyên tố nào
A. s |
B. d |
C. f |
D. p |
Câu 12. Nguyên tử của nguyên tố nào sau đây luôn nhường 1 electron trong các phản ứng hóa học?
A. Na ở ô 11 trong bảng tuần hoàn.
B. Mg ở ô 12 trong bảng tuần hoàn.
C. Ba ở ô 13 trong bảng tuần hoàn.
D. Fe ở ô 14 trong bảng tuần hoàn.
Câu 13. Dãy nguyên tử nào sau đây được xếp theo chiều bán kính nguyên tử tăng dần?
A. I, Br, Cl, P. B. C, N, O, F.
C. Na, Mg, Al, Si. D. O, S, Se, Te.
Câu 14. Các nguyên tố của nhóm IA trong bảng tuần hoàn có đặc điểm chung nào về cấu hình electron nguyên tử, mà quyết định tính chất hóa học của nhóm?
A. Số nơtron trong hạt nhân nguyên tử.
B. Số electron lớp K = 2.
C. Số lớp electron như nhau.
D. Số electron lớp ngoài cùng bằng 1.
Câu 15. Cho 6,5 gam kẽm tác dụng hết với dung dịch HCl sau phản ứng thu được V lít khí H2 (đktc). Tính giá trị của V
A. 1,12 B. 2,24 C. 3,36 D. 4,48
Câu 16. Độ âm điện của dãy nguyên tố: Na (Z = 11), Mg (Z = 12), Al (Z = 13), P (Z = 15), Cl (Z = 17) biến đổi theo chiều nào?
A. Tăng B. Giảm C. Không thay đổi D. Vừa giảm vừa tăng.
Câu 17. Một nguyên tố thuộc nhóm VIA có tổng số proton, nơtron và electron trong nguyên tử là 24. Cấu hình electron nguyên tử của nguyên tố đó là:
A. 1s22s22p2
B. 1s22s22p3
C. 1s22s22p4
D. 1s22s22p5
Câu 18. Nguyên tố hóa học Canxi (Ca) có số hiệu nguyên tử là 20, chu kì 4, nhóm IIA. Điều khẳng định nào sau đây là sai?
A. Số electron lớp vỏ nguyên tử của nguyên tố là 20.
B. Vỏ nguyên tử có electron 4 lớp electron và lớp ngoài cùng có 2 electron.
C. Hạt nhân nguyên tử có 20 proton.
D. Nguyên tố hóa học này là một phi kim.
Câu 19. Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số proton trong hai hạt nhân nguyên tử là 25. X và Y tuộc chu kì và các nhóm nào?
A. Chu kì 2 và các nhóm IIA và IIIA.
B. Chu kì 3 và các nhóm IA và IIA.
C. Chu kì 2 và các nhóm IIIA và IVA.
D. Chu kì 3 và các nhóm IIA và IIIA.
Câu 20. Cho phân tử MX có tổng số các hạt cơ bản (e, p, n) là 86; tổng số khối của hai nguyên tố là 58. Số hiệu của nguyên tố M hơn của nguyên tố X là 10. Trong nguyên tử M có số hạt mang điện nhiều hơn số hạt không mang điện là 8. Công thức phân tử của chất trên là gì?
A. NaCl B. KCl C. KF D. LiCl
Câu 21. Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34. Trong đó có số hạt mang điện nhiều hơn số hạt không mang điện là 1,833 lần. Nguyên tố R là:
A. Na B. Mg C. F D. Ne
Câu 22. Cho biết sắt có số hiệu nguyên tử là 26. Cấu hình electron của ion Fe2+ là:
A.1s22s22p63s23p63d64s2
B.1s22s22p63s23p63d64s1
C.1s22s22p63s23p63d6
D. 1s22s22p63s23p63d5
Câu 23. Trong nguyên tử một nguyên tố X có 29 electron và 36 nơtron. Số khối và số lớp electron của nguyên tử X lần lượt là:
A. 64 và 4 B. 65 và 4 C. 65 và 3 D. 64 và 3
Câu 24. Nguyên tử của nguyên tố hóa học nào sau đây có cấu hình electron là 1s22s22p53s23p63d104s2
A. Ni (Z = 28). B. Cu (Z = 29). C. Fe (Z = 26). D. Co (Z = 27).
Câu 25. Nguyên tử của một nguyên tố X có tổng số hạt cơ bản (proton, nơtron, và electron) là 82, biết số hạt mạng điện nhiều hơn số hạt không mang điện là 22. Kí hiệu hóa học của X là
A. Fe B. Cu C. Mg D. Ni

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2023
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
(Cho C=12, O=16, H=1, Na=23,K=39,Mg =24, Ca=40, P=31, Cl =35,5, F=9, Si =27, N=14, S=32)
I- TRẮC NGHIỆM (7 Điểm)
Câu 1: Nguyên tố canxi có số hiệu nguyên tử là 20, thuộc chu kỳ 4, nhóm IIA. Điều khẳng định nào sau đây về canxi là sai?
A. Số electron ở vỏ nguyên tử của nguyên tố canxi là 20 .
B. Hạt nhân nguyên tử canxi có 20 proton.
C. Vỏ nguyên tử canxi có 4 lớp và lớp ngoài cùng có 2 electron.
D. Nguyên tố hóa học này là một phi kim.
Câu 2: Các phân lớp có trong lớp L là
A. 3s; 3p; 3d B. 3s; 3p; 3d:3f C. 2s; 2p D. 4s; 4p; 4d; 4f.
Câu 3: Phân lớp d có chứa số electron tối đa là
A. 18. B. 14. C. 6. D. 10.
Câu 4: Mệnh đề nào sau đây đúng?
A. Đồng vị là những nguyên tử có cùng số khối nhưng khác số proton.
B. Đồng vị là những nguyên tố có cùng điện tích hạt nhân nhưng khác nhau về số nơtron nên số khối khác nhau.
C. Đồng vị là những nguyên tố có cùng số khối.
D. Đồng vị là những nguyên tử có cùng điện tích hạt nhân nhưng số hạt nơtron khác nhau.
Câu 5: Biết rằng nguyên tố cacbon thuộc chu kỳ 2, nhóm IVA. Cấu hình electron của cacbon là :
A. 1s22s22p2. B. 1s22s22p3. C. 1s22s22p63s23p64s2 D. 1s22s22p4
Câu 6: Các kim loại thuộc nhóm IA trong bảng tuần hoàn có tên gọi là
A. nhóm khí hiếm. B. nhóm halogen.
C. nhóm kim loại kiềm thổ. D. nhóm kim loại kiềm.
Câu 7: Nguyên tố R có cấu hình electron nguyên tử là 1s22s22p3. Công thức hợp chất với hiđro và công thức oxit cao nhất là
A. RH3, R2O5 B. RH4, R2O5 C. RH3, R2O3 D. RH2, RO3
Câu 8: Nguyên tử S (Z=16) nhận thêm 2e thì cấu hình e tương ứng của nó là
A. 1s22s22p63s1 B. 1s22s22p6 C. 1s22s22p63s3 D. 1s22s22p63s23p6
Câu 9: Nguyên tử của nguyên tố nào sau đây có cấu hình electron 1s22s22p63s23p64s1 ?
A. Mg (Z = 12). B. Ca (Z = 20). C. Na (Z = 11). D. K (Z = 19).
Câu 10: Hạt mang điện tích dương là
A. proton và electron B. electron. C. proton. D. nơtron.
Câu 11: Số hiệu nguyên tử của các nguyên tố cho biết
A. số electron hoá trị và số nơtron. B. số electron và số proton trong nguyên tử.
C. số electron trong nguyên tử và số khối. D. số proton trong hạt nhân và số nơtron.
Câu 12: Một nguyên tử X có tổng số electron là 8, nguyên tố X thuộc loại:
A. Nguyên tố s. B. Nguyên tố p. C. Nguyên tố D. D. Nguyên tố f.
Câu 13: Các nguyên tố xếp ở chu kỳ 6 có số lớp electron trong nguyên tử là:
A. 6. B. 7. C. 3. D. 5.
Câu 14: Nguyên tử clo có 2 đồng vị: 35Cl chiếm 75,77%; 37Cl chiếm 24,23% tổng số nguyên tử clo trong tự nhiên. Nguyên tử khối trung bình của clo là
A. 35,45. B. 35,50. C. 35,00. D. 35,67.
Câu 15: Tìm câu sai trong các câu sau đây:
A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kỳ và các nhóm.
B. Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
C. Bảng tuần hoàn có 7 chu kỳ. Số thứ tự của chu kỳ bằng số phân lớp electron trong nguyên tử.
D. Bảng tuần hoàn có 8 nhóm A và 8 nhóm B.
Câu 16: Cấu hình electron của nguyên tử có số hiệu Z = 17 là
A. 1s22s22p63s23p44s1. B. 1s22s22p63s23d5.
C. 1s22s22p63s23p5. D. 1s22s22p63s23p34s2.
Câu 17: Nguyên tử của nguyên tố X có số proton là 13. Điện tích hạt nhân của nguyên tử X là:
A. 13 B. 13- C. +13 D. 13+
Câu 18: Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân
A. bán kính nguyên tử giảm dần, tính kim loại tăng dần.
B. bán kính nguyên tử giảm dần, tính phi kim tăng dần.
C. bán kính nguyên tử tăng dần, tính phi kim tăng dần.
D. bán kính nguyên tử tăng dần, tính phi kim giảm dần.
Câu 19: Nguyên tố A có Z = 18, vị trí của A trong bảng tuần hoàn là
A. chu kì 3, phân nhóm VIIIA. B. chu kì 3, phân nhóm VIB.
C. chu kì 3, phân nhóm VIA. D. chu kì 3, phân nhóm VIIIB.
Câu 20: Cho biết cấu hình electron của các nguyên tố X: 1s22s22p63s23p4; Y: 1s22s22p63s23p64s2; Z: 1s22s22p63s23p6. Nguyên tố nào là kim loại?
A. X. B. Y. C. X và Y. D. Z.
Câu 21: Cho các phát biểu sau
(a) Trong một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
(b) Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân thì độ âm điện tăng dần
(c) Các nguyên tố nhóm VIIA đều có tính phi kim mạnh
(d) Xesi là kim loại mạnh nhất
(e) Chỉ có nguyên tử K mới chứa phân lớp electron 4s1.
Số phát biểu sai là:
A. 1. B. 4. C. 2. D. 3.
Câu 22: Nguyên tử 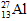 có
có
A. 13p, 14e, 13n. B. 13p, 13e, 14n. C. 13p, 14e, 14n. D. 14p, 14e, 13n.
Câu 23: Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
A. 23. B. 27. C. 26. D. 28.
Câu 24: Phát biểu nào sau đây về sự chuyển động của e trong nguyên tử là đúng?
A. Các e chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định.
B. Các e chuyển động rất nhanh xung quanh hạt nhân theo quỹ đạo hình bầu dục.
C. Các e chuyển động rất nhanh xung quanh hạt nhân theo quỹ đạo hình cong.
D. Các e chuyển động rất nhanh xung quanh hạt nhân theo quỹ đạo hình tròn.
Câu 25: Ý nào sau đây không biến đổi tuần hoàn?
A. Số lớp electron B. Tính kim loại, tính phi kim
C. Số electron lớp ngoài cùng D. Hóa trị cao nhất với oxi
Câu 26: Nguyên tố R có công thức oxit cao nhất là RO3. Vậy công thức hợp chất khí với hiđro là
A. RH B. RH4 C. RH2 D. RH3
Câu 27: Một nguyên tố R có Z =14. Hợp chất của nó với oxi có dạng
A. RO2 B. R2O3 C. R2O5 D. RO3
Câu 28: Nhóm nguyên tố là tập hợp các nguyên tố, mà nguyên tử của các nguyên tố này có cùng
A. số electron. B. số lớp electron.
C. số electron hóa trị. D. số electron lớp ngoài cùng.
----------------------------------
II- TỰ LUẬN (3 Điểm)
Câu 1: (2 điểm) Xác định vị trí (STT, Chu kì, Nhóm) ; Tính chất hóa học ( Kim loại, Phi kim, Khí hiếm) của các nguyên tố sau (có giải thích ngắn gọn) ?
a) F (Z = 9);
b) K (Z = 19)
Câu 2: Hợp chất khí với hiđro của một nguyên tố là RH3. Trong công thức oxit cao nhất của nó chứa 25,93% R về khối lượng. Xác định tên nguyên tố R?

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2023
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 5)
(Cho C=12, O=16, H=1, Na=23,K=39,Mg =24, Ca=40, P=31, Cl =35,5, F=9, Si =27, N=14, S=32)
I- TRẮC NGHIỆM (7 Điểm)
Câu 1: Nguyên tử Na (Z=11) bị mất đi 1e thì cấu hình e tương ứng của nó là:
A. 1s22s22p6 B. 1s22s22p63s1 C. 1s22s22p63s3 D. 1s22s22p63s23p64s1
Câu 2: Chu kì là tập hợp các nguyên tố, mà nguyên tử của các nguyên tố này có cùng
A. số electron. B. số electron ở lớp ngoài cùng
C. số lớp electron. D. số electron hóa trị.
Câu 3: Nguyên tố hoá học là
A. tập hợp các nguyên tử có cùng điện tích hạt nhân.
B. tập hợp các nguyên tử có số nơtron giống nhau.
C. tập hợp các nguyên tử có khối lượng giống nhau
D. tập hợp các nguyên tử có cùng số khối.
Câu 4: Khối lượng nguyên tử hầu như tập trung ở
A. hạt nhân. B. hạt proton. C. hạt nơtron. D. vỏ nguyên tử.
Câu 5: Nguyên tố R có công thức hợp chất khí với hiđro cao nhất là RH2. Vậy công thức oxit là
A. R2O3 B. RO2 C. RO D. RO3
Câu 6: Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là:
A. 2, 6, 10, 14. B. 2, 8, 18, 32. C. 2, 6, 8, 18. D. 2, 4, 6, 8.
Câu 7: Các hạt cấu tạo nên hầu hết các nguyên tử là
A. proton, nơtron. B. electron, proton.
C. nơtron, electron. D. electron, nơtron, proton.
Câu 8: Cho các phát biểu sau
(a) Trong một chu kì, theo chiều tăng của điện tích hạt nhân thì tính kim loại giảm dần
(b) Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân thì tính phi kim tăng dần
(c) Các nguyên tố nhóm IA đều có tính kim loại mạnh
(d) Flo là phi kim mạnh nhất
(e) Chỉ có nguyên tử K mới chứa phân lớp electron 4s1.
Số phát biểu sai là:
A. 1. B. 2. C. 3. D. 4.
Câu 9: Cấu hình electron đầy đủ cho các nguyên tử có cấu hình electron lớp ngoài cùng 3s23p4 là:
A. 1s22s22p53s23p4 B. 1s22s22p63s23p4 C. 1s22s22p63s23p6 D. 1s22s23s23p4
Câu 10: Một nguyên tố R có Z =13. Công thức oxit cao nhất có dạng.
A. R2O3 B. R2O5 C. RO2 D. RO3
Câu 11: Nguyên tử của nguyên tố nào sau đây có cấu hình electron 1s22s22p63s23p64s2 ?
A. Mg B. Ca C. Na D. K
Câu 12: Tổng các hạt cơ bản trong một nguyên tử là 82 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của nguyên tử đó là
A. 56 B. 65 C. 57 D. 55
Câu 13: Các nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn có tên gọi là
A. nhóm khí hiếm. B. nhóm kim loại kiềm thổ.
C. nhóm halogen. D. nhóm kim loại kiềm.
Câu 14: Nguyên tố M có số hiệu nguyên tử là 17, vị trí của A trong bảng tuần hoàn là
A. chu kì 3, phân nhóm VIIIA. B. chu kì 3, phân nhóm VIIA.
C. chu kì 3, phân nhóm VIA. D. chu kì 3, phân nhóm VA.
Câu 15: Vỏ nguyên tử gồm các electron chuyển động như thế nào xung quanh hạt nhân?
A. Chuyển động rất nhanh theo những quỹ đạo xác định.
B. Chuyển động rất chậm và không theo những quỹ đạo xác định.
C. Chuyển động rất nhanh không theo những quỹ đạo xác định.
D. Chuyển động rất không nhanh và không theo những quỹ đạo xác định.
Câu 16: Trong các hạt sau, hạt nào không mang điện tích?
A. Nơtron và electron B. proton C. electron D. nơtron
Câu 17: Tính số p và n trong hạt nhân nguyên tử 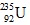
A. 92p,143n. B. 92p, 143p. C. 92p, 235n. D. 92n, 235p.
Câu 18: Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn:
(a) Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử;
(b) Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một hàng;
(c) Các nguyên tố có cùng số electron hóa trị được xếp vào một cột;
(d) Các nguyên tố có cùng số phân lớp electron trong nguyên tử được xếp vào cùng một hàng;
Số nguyên tắc đúng là
A. 2. B. 1. C. 3. D. 4.
Câu 19: Nguyên tố canxi có số hiệu nguyên tử là 20, thuộc chu kỳ 4, nhóm IIA. Điều khẳng định nào sau đây về canxi là sai ?
A. Số electron ở vỏ nguyên tử của nguyên tố canxi là 20 .
B. Vỏ nguyên tử canxi có 4 lớp và lớp ngoài cùng có 2 electron.
C. Hạt nhân nguyên tử canxi có 20 proton.
D. Nguyên tố hóa học này là một phi kim.
Câu 20: Cho biết cấu hình electron của các nguyên tố X: 1s22s22p63s2; Y: 1s22s22p63s23p64s1;
Z: 1s22s22p63s23p5. Nguyên tố nào là kim loại?
A. X. B. Z. C. X và Y. D. Y.
Câu 21: Ý nào sau đây không biến đổi tuần hoàn?
A. Hóa trị cao nhất với oxi B. Số lớp electron
C. Tính kim loại, tính phi kim D. Số electron lớp ngoài cùng
Câu 22: Một nguyên tử A có tổng số electron là 10, nguyên tố Y thuộc loại:
A. Nguyên tố s. B. Nguyên tố p. C. D. Nguyên tố f. D. Nguyên tố
Câu 23: Biết rằng nguyên tố cacbon thuộc chu kỳ 2, nhóm VIA. Cấu hình electron của cacbon là :
A. 1s22s22p63s23p64s2 B. 1s22s22p3. C. 1s22s22p2. D. 1s22s22p4
Câu 24: Trong tự nhiên Gali có 2 đồng vị là 69Ga (60,1%) và 71Ga (39,9%). Nguyên tử khối trung bình của Gali là:
A. 71,20 B. 70 C. 70,20 D. 69,80
Câu 25: Nguyên tử của nguyên tố Y có số electron là 13. Điện tích hạt nhân của nguyên tử Y là:
A. 13 B. 13- C. 13+ D. +13
Câu 26: Cấu hình electron của nguyên tử X: 1s22s22p63s23p5. Hợp chất với hidro và oxi cao nhất có dạng
A. H2X, XO3. B. HX, X2O7. C. XH4, XO2. D. H3X, X2O5.
Câu 27: Trong một chu kì theo chiều tăng của điện tích hạt nhân nguyên tử
A. Bán kính nguyên tử tăng và độ âm điện giảm
B. Bán kính nguyên tử và độ âm điện tăng
C. Bán kính nguyên tử và độ âm điện giảm
D. Bán kính nguyên tử giảm và độ âm điện tăng
Câu 28: Trong bảng tuần hoàn các nguyên tố, số chu kỳ nhỏ và chu kỳ lớn là:
A. 3 và 3. B. 4 và 3. C. 3 và 4. D. 4 và 4.
II- Tự luận (3 Điểm)
Câu 1: (2 điểm) Xác định vị trí (STT, Chu kì, Nhóm) ; Tính chất hóa học ( Kim loại, Phi kim, Khí hiếm) của các nguyên tố sau (có giải thích ngắn gọn) ?
a) S (Z = 16)
b) Al (Z = 13)
Câu 2: (1 điểm) Công thức oxit cao nhất của nguyên tố R có dạng RO2. Trong hợp chất khí với hiđro, R chiếm 87,5% về khối lượng. Xác định tên nguyên tố R?
..........................
..........................
..........................
Tải xuống để xem tài liệu đề thi Hóa học lớp 10 Giữa học kì 1 năm 2023 đầy đủ!

