Đề thi Hóa học lớp 10 Học kì 1 năm 2023 có đáp án (20 đề) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
Đề thi Hóa học lớp 10 Học kì 1 năm 2023 có đáp án (20 đề) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
Với Đề thi Hóa học lớp 10 Học kì 1 năm 2023 có đáp án (20 đề) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo được tổng hợp chọn lọc từ đề thi môn Hóa học 10 của các trường trên cả nước sẽ giúp học sinh có kế hoạch ôn luyện từ đó đạt điểm cao trong các bài thi Hóa học lớp 10.

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 1)
Phần trắc nghiệm
Câu 1: Điều khẳng định nào sau đây là sai?
A. Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, nơtron.
B. Trong nguyên tử số hạt proton bằng số hạt electron.
C. Số khối A bằng tổng số proton (Z) và tổng số nơtron (N).
D. Nguyên tử được cấu tạo nên bởi các hạt proton, electron, nơtron.
Câu 2: Hòa tan hoàn toàn 6 gam một kim loại M hóa trị II vào dung dịch HCl, sau phản ứng thu được 3,36 lit khí H2 (đktc). Kim loại M là:
A. Zn (65) B. Mg (24)
C. Fe (56) D. Ca (40)
Câu 3: Anion X có phân lớp ngoài cùng là 3p6. Nguyên tố X thuộc:
A. nhóm IIA, chu kì 4
B. nhóm VIIA, chu kì 3
C. nhóm VIIIA, chu kì 3
D. nhóm VIA, chu kì 3
Câu 4: Trong tự nhiên nguyên tố clo có hai đồng vị 35Cl và 37Cl, nguyên tử khối trung bình của Cl là 35,48. Số nguyên tử đồng vị 35Cl có trong 200 nguyên tử clo là?
A. 132 B. 48 C. 76 D. 152
Câu 5: Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là:
A. K, Mg, N, Si. B. Mg, K, Si, N.
C. K, Mg, Si, N. D. N, Si, Mg, K.
Câu 6: Nhóm hợp chất nào sau đây chỉ có liên kết ion:
A. Na2O, CO, BaO. B. BaO, CaCl2, BaF2.
C. CS2, H2O, HF. D. CaO, CH4, NH3.
Câu 7: Nguyên tử của một nguyên tố R có tổng số các loại hạt bằng 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số hiệu nguyên tử của R là:
A. 56 B. 30 C. 26 D. 24
Câu 8: Phát biểu nào sau đây sai:
A. Điện hóa trị có trong hợp chất ion.
B. Điện hóa trị bằng số cặp electron dùng chung.
C. Cộng hóa trị có trong hợp chất cộng hóa trị
D. Cộng hóa trị bằng số cặp electron dùng chung.
Câu 9: Trong phản ứng hóa học: Cl2 + 2NaBr → 2NaCl + Br2. Cl2 đóng vai trò:
A. chất bị khử
B. chất bị oxi hóa
C. chất vừa bị oxi hóa, vừa bị khử
D. chất không bị oxi hóa, không bị khử.
Câu 10: Cation R+ có cấu hình e lớp ngoài cùng là 3p6. Cấu hình electron đầy đủ của R là:
A. 1s22s22p63s23p6
B. 1s22s22p63s23p5
C. 1s22s22p63s23p63d1
D. 1s22s22p63s23p64s1
Phần tự luận
Câu 1: (2 điểm)
Biết nguyên tố R ở chu kì 3, nhóm VA trong bảng tuần hoàn.
a) Viết cấu hình electron và xác định số đơn vị điện tích hạt nhân của R?
b) Viết công thức phân tử và công thức cấu tạo của oxit bậc cao, của hiđroxit và hợp chất khí với hiđro của R?
Câu 2: (2 điểm)
Cân bằng PTHH của các phản ứng oxi hoá- khử sau bằng phương pháp thăng bằng electron (xác định chất khử, chất oxi hoá, quá trình khử, quá trình oxi hóa).
a) Cu + H2SO4 đ, n → CuSO4 + SO2 + H2O
b) Al + HNO3 → Al(NO3)3 + NO + NH4NO3 + H2O
Câu 3: (1 điểm)
Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH4. Trong oxit mà R có hoá trị cao nhất thì oxi chiếm 53,3% về khối lượng. Xác định nguyên tố R ?
Học sinh không sử dụng bảng hệ thống tuần hoàn các nguyên tố hóa học
Đáp án và Thang điểm
Phần trắc nghiệm
Câu 1. A
Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton và nơtron.
Câu 2. D
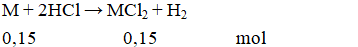
MM = 6 : 0,15 = 40.
Vậy kim loại M là Ca.
Câu 3. B
Cấu hình electron của X là 1s22s22p63s23p5
Vậy X thuộc chu kỳ 3 do có 3 lớp electron, nhóm VII A do có 7 e lớp ngoài cùng, nguyên tố p.
Câu 4. D
Gọi % số nguyên tử của hai đồng vị 35Cl và 37Cl lần lượt là x và y
Ta có x + y = 100.
Theo bài ra ta có:
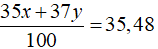
Giải hệ phương trình được x = 76 và y = 24.
Số nguyên tử 35Cl có trong 200 nguyên tử Cl là
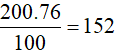
Câu 5. C
N và Si thuộc cùng nhóm IV A có ZN < ZSi → Bán kính Si > N.
Si và Mg thuộc cùng chu kỳ 3 có ZMg < ZSi → bán kính Mg > Si.
Có K và Na thuộc cùng nhóm IA có ZNa < ZK → bán kính K > Na. Có Na và Mg thuộc cùng chu kỳ 3 có ZNa < ZMg → bán kính Na > Mg. Vậy bán kính K > Mg.
Chiều giảm dần bán kính: K > Mg > Si > Mg.
Câu 6. B
Các hợp chất BaO; CaCl2 và BaF2 tạo nên bởi kim loại điển hình và phi kim điển hình nên là hợp chất ion.
Câu 7. C
Gọi số proton, nơtron và electron của R lần lượt là p, n và e trong đó p = e.
Theo bài ra ta có: 2p + n = 82 và 2p – n = 22.
Giải hệ phương trình được p = 26 và n = 30.
Số hiệu nguyên tử của R là 26.
Câu 8. B
Điện hóa trị bằng điện tích ion.
Câu 9. A
Clo có số oxi hóa giảm từ 0 xuống -1 sau phản ứng nên Cl2 là chất oxi hóa hay chất bị khử.
Câu 10. D
R → R+ + 1e
Cấu hình electron của R là 1s22s22p63s23p64s1
Phần tự luận
Câu 1: (2 điểm)
a. Viết cấu hình electron: 1s22s22p63s23p3 , Z+ = 15+
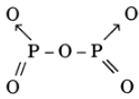
b. CTPT R2O5, H3RO4, RH3 (HS ghi R là P cũng được)
- Viết công thức cấu tạo 3 chất trên.
P2O5 :
H3PO4:
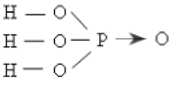
PH3:
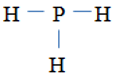
Câu 2: (2 điểm)
Mỗi phản ứng 1 điểm
a) Cu + 2 H2SO4 đ,n → CuSO4 + SO2 + 2H2O
Cu: Chất khử
H2SO4 đ,n: Chất oxi hóa
Cu0 → Cu2+ + 2e quá trình oxi hóa
S+6 + 2e → S+4 quá trình khử
b) 11Al + 42 HNO3 → 11 Al(NO3)3 + 3 NO + 3 NH4NO3 + 15 H2O
Al: chất khử
HNO3: chất oxi hóa
Al0 → Al3+ + 3e quá trình oxi hóa
2N+5 + 11e → N+2 + N-3 quá trình khử
Câu 3: (1 điểm)
Ứng với công thức RH4 ⇒ CT oxit bậc cao là RO2
%O = 53,3% ⇒ %R = 46,7%
Lập tỉ lệ 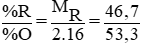
⇒ MR = 28 , R là nguyên tố Si
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 2)
Bài giảng: Đề thi Học kì 1 Hóa 10 (Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Phần trắc nghiệm
Câu 1: Tổng số hạt cơ bản (p, n, e) trong nguyên tử nguyên tố X là 46, biết số hạt mang điện nhiều hơn số hạt không mang điện là 14. Xác định chu kì, số thứ tự ô nguyên tố của X trong bảng tuần hoàn.
A. Chu kì 2, ô 7 B. Chu kì 3 ô 17
C. Chu kì 3 ô 16 D. Chu kì 3, ô 15
Câu 2: Tính chất phi kim của các nguyên tố trong dãy N - P - As - Sb - Bi (nhóm VA) biến đổi theo chiều:
A. Tăng B. Không thay đổi
C. Vừa giảm vừa tăng. D. Giảm
Câu 3: Cho các phân tử N2, HCl, NaCl, MgO. Các phân tử đều có liên kết cộng hóa trị là
A. NaCl và MgO B. HCl và MgO
C. N2 và NaCl D. N2 và HCl
Câu 4: Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. ion. B. Cộng hoá trị.
C. Kim loại. D. Cho nhận
Câu 5: Cho biết cấu hình electron của nguyên tố A là 1s22s22p63s23p4 và cấu hình electron của nguyên tố B là 1s22s22p63s1. Phát biểu đúng là
A. Nguyên tố A là KL, nguyên tố B là PK
B. Nguyên tố A là PK, nguyên tố B là KL.
C. Nguyên tố A, nguyên tố B đều là PK
D. Nguyên tố A, nguyên tố B đều là KL.
Câu 6: Hợp chất của một nguyên tố có công thức RH2. Oxit cao nhất của R chiếm 40% khối lượng R. R là:
A. N (M = 14) B. Se (M = 79).
C. S (M = 32) D. Ca (M = 40)
Câu 7: Cho phương trình phản ứng hóa học sau:
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O. Trong phản ứng trên chất khử là:
A. Fe B. HNO3
C. Fe(NO3)3 D. N2O
Câu 8: Nguyên tố X có Z = 20. Vị trí của X trong hệ thống hoàn:
A. Tất cả đều sai
B. Chu kì 3, nhóm IA
C. Chu kì 4, nhóm IIA
D. Chu kì 4, nhóm IIIA.
Câu 9: Trong các phân tử sau, phân tử có liên kết ba giữa hai nguyên tử là:
A. Khí flo. B. Khí cacbonic.
C. Khí hyđrô. D. Khí nitơ.
Câu 10: Số oxi hóa của lưu huỳnh trong các phân tử và ion sau: SO42-, H2SO4, H2SO3 lần lượt là
A. -2, +4, +6. B. +6, +4, +6.
C. +6, +6, +4. D. +4, +6, +6.
Câu 11: Trong các phản ứng sau, phản ứng nào không phải là phản ứng oxy hóa khử.
A. Fe + 2HCl → FeCl2
B. Fe + CuSO4 → FeSO4 + Cu.
C. 2FeCl3 + Fe → 3FeCl3
D. FeS + 2HCl → FeCl2 + H2S
Câu 12: Trong phản ứng hoá học sau: 3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O. Cl2 đóng vai trò là gì?
A. Chỉ là chất oxi hoá
B. Vừa là chất oxi hoá, vừa là chất khử
C. Chỉ là chất khử.
D. Không phải là chất oxi hoá, không phải là chất khử
Phần tự luận
Câu 1: (2 điểm)
Khi cho 0,9g một kim loại X thuộc nhóm IIA tác dụng với nước thì được 0,504 lít H2 (đkct). Tìm kim loại X.
Câu 2: (2 điểm)
Cho PTH Zn + HNO3 → Zn(NO3)2 + NO2 + H2O
a) Cân bằng PTHH trên?
b) Tính thể tích khí NO2 thu được ở đktc khi cho 13g Zn tác dụng với 400ml HNO3 2,5M.
Đáp án và Thang điểm
Câu 1. D
Gọi số hạt proton, nơtron và electron của X lần lượt là p, n và e.
Theo bài ra ta có: 2p + n = 46 và 2p – n = 14.
Giải hệ phương trình ta được: p = 15 và n = 16.
Vậy X ở ô 15. Cấu hình electron của X là 1s22s22p63s23p3. Vậy X ở chu kỳ 3.
Câu 2. D
Trong một nhóm A, theo chiều từ trên xuống dưới (chiều tăng dần của điện tích hạt nhân) tính phi kim của các nguyên tố giảm dần.
Câu 3. D
Phân tử N2 và HCl được cấu tạo nên từ các phi kim do đó liên kết trong phân tử là liên kết cộng hóa trị.
Câu 4. A
X có 1 e lớp ngoài cùng do đó X là kim loại điển hình.
Y có 7 e lớp ngoài cùng do đó Y là phi kim điển hình.
Vậy liên kết giữa nguyên tử X và Y là liên kết ion.
Câu 5. B
A có 6 e ở lớp ngoài cùng do đó A là phi kim.
B có 1 e ở lớp ngoài cùng do đó B là kim loại.
Câu 6. C
Oxit cao nhất của R có dạng RO3.
Theo bài ra có:
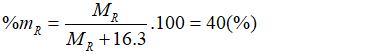
→ R = 32. Vậy R là lưu huỳnh (S).
Câu 7. A
Số oxi hóa của Fe tăng từ 0 lên +3 sau phản ứng. Vậy Fe là chất khử.
Câu 8. C
Cấu hình electron nguyên tử của X là: 1s22s22p63s23p64s1.
Vậy X ở chu kỳ 4, nhóm IIA.
Câu 9. D
Ta có CTCT của các chất:
F – F; O = C = O; H – H; N ≡ N.
Vậy chỉ có phân tử chỉ có liên kết ba giữa hai nguyên tử là N2.
Câu 10. C
SO42-: Gọi số oxi hóa S là x ta có:
x + (-2).4 = -2. Vậy x = +6.
H2SO4: Gọi số oxi hóa S là x ta có:
(+1).2 + x + (-2).4 = 0. Vậy x = +6.
H2SO3: Gọi số oxi hóa S là x ta có:
(+1).2 + x + (-2).3 = 0. Vậy x = +4.
Câu 11. D
FeS + 2HCl → FeCl2 + H2S
Phản ứng này không có sự thay đổi số oxi hóa của các nguyên tố sau phản ứng nên không là phản ứng oxi hóa – khử.
Câu 12. B
Clo có số oxi hóa tăng từ 0 lên +5 và giảm từ 0 xuống -1 sau phản ứng nên Cl2 vừa đóng vai trò là chất oxi hóa vừa đóng vai trò là chất khử.
Phần tự luận
Câu 1: (2 điểm)
nH2 = 0,504/22,4 = 0,0225 mol
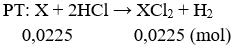
Theo pt: nX = nH2 = 0,0225 mol
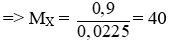
Vậy X là Ca.
Câu 2: (2 điểm)
a. Cân bằng PTHH
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
b. Số mol của Zn là 13/65 = 0,2 mol
Số mol của HNO3 là 0,4.2,5 = 1 mol
Ta có tỉ lệ: 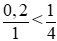
⇒ Số mol NO2 = 2. nZn = 2.0,2= 0,4 mol.
VNO2 = 0,4. 22,4 = 8,96 lit
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 3)
Bài giảng: Đề thi Học kì 1 Hóa 10 (Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Phần trắc nghiệm
Câu 1: Kí hiệu nào trong số các kí hiệu sau là sai?
A. 2s, 4f B. 1p, 2d C. 2p, 3d D. 1s, 2p
Câu 2: Số hạt p, n, e trong ion 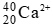
A. 20, 19, 18 B. 18, 18, 20
C. 20, 20, 18 D. 20, 20, 20
Câu 3: Cho 3 nguyên tố X (Z = 14), Y (Z = 17), Z (Z = 15). Dãy các nguyên tố có bán kính nguyên tử tăng dần là:
A. X, Y, Z B. Z, Y, X
C. X, Z, Y D. Y, Z, X
Câu 4: Nguyên tử của nguyên tố X có tổng số hạt là 40. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là:
A. 27 B. 26 C. 28 D. 29
Câu 5: Số oxi hóa của nitơ trong các hợp chất HNO3, NO, N2O, NH3 theo thứ tự là
A. -5, -2, +1, -3.
B. +5, +2, +1, -3
C. +5, +2, +1, +3.
D. +5, +2, -1, -3
Câu 6: Nguyên tố X có hai đồng vị, đồng vị thứ nhất 35X chiếm 75%. Nguyên tử khối trung bình của X là 35,5. Đồng vị thứ hai là:
A. 34X B. 36X C. 37X D. 38X
Phần tự luận
Câu 1: (2,5 điểm)
Cho các nguyên tố sau: X (Z = 12); Y (Z = 34); G (Z = 22); H (Z = 29)
a) Viết cấu hình electron nguyên tử (đầy đủ) của 4 nguyên tố trên. (1,0 điểm)
b) Xác định vị trí của 2 nguyên tố X, G trong bảng tuần hoàn. Giải thích? (1,0 điểm)
c) Cho biết tính chất của 2 nguyên tố Y, H (kim loại, phi kim hay khí hiếm). Giải thích? (0,5 điểm)
Câu 2: (1,5 điểm)
Cho các phân tử sau: KCl, H2O, N2 và Na2O.
Biết số hiệu nguyên tử của các nguyên tố lần lượt là: H = 1, N = 7, O = 8, Na = 11, Cl = 17, K = 19.
a) Xác định loại liên kết hoá học trong các phân tử trên (liên kết ion, liên kết cộng hoá trị phân cực hay liên kết cộng hoá trị không cực)? (0,5 điểm)
b) Viết công thức electron và công thức cấu tạo của các phân tử chứa liên kết cộng hoá trị. (1,0 điểm)
Câu 3: (3,0 điểm)
Hoà tan hoàn toàn 16,5 gam hỗn hợp A gồm Fe và Al vào 500 dung dịch HCl 2,5M (d =1,1g/ml) thu được 13,44 lít H2 (đktc) và dung dịch B
a) Tính % khối lượng mỗi kim loại trong hỗn hợp A. (1,5 điểm)
b) Tính C% các chất trong dung dịch B. (1,0 điểm)
c) Thực hiện oxi hoá hỗn hợp A với lượng như trên ngoài không khí sau một thời gian thu được hỗn hợp rắn X gồm Al2O3 và Fe3O4. Hoà tan hết hỗn hợp X bằng dung dịch HCl được dùng dư 10% so với lượng cần thiết thu được dung dịch Y. Tính thể tích dung dịch KOH 5M tối thiểu cần cho vào dung dịch Y để thu được lượng kết tủa không đổi. (0,5 điểm)
(Cho H = 1, O = 16, Cl = 35,5, Fe = 56, Al = 27)
Đáp án và Thang điểm
Phần trắc nghiệm
Câu 1. B
Không có phân lớp 2d.
Câu 2. C
Số hạt p = z = 20
Số hạt n = A – z = 40 – 20 = 20.
Số hạt e = 20 – 2 = 18
Câu 3. D
Ta có X, Y, Z thuộc cùng chu kỳ, ZX < ZZ < ZY
→ Bán kính nguyên tử: Y < Z < X.
Câu 4. A
Gọi số hạt proton, nơtron, electron trong X lần lượt là p, n và e (trong đó p = e)
Theo bài ra có: 2p + n = 40 và 2p – n = 12.
Giải hệ phương trình được p = 13 và n = 14.
Số khối A = 13 + 14 = 27.
Câu 5. B
+) HNO3: Gọi số oxi hóa của N là x có:
(+1) + x + (-2).3 = 0 → x = + 5.
+) NO: Gọi số oxi hóa của N là x có:
x +(-2) = 0 → x = +2.
+) N2O: Gọi số oxi hóa của N là x có:
x.2 +(-2) = 0 → x = +1
+) NH3: Gọi số oxi hóa của N là x có:
x +(+1).3 = 0 → x = -3.
Câu 6. C
Gọi nguyên tử khối trung bình của đồng vị thứ 2 là x
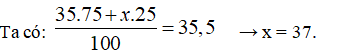
Phần tự luận
Câu 1: (2,5 điểm)
a) Cấu hình electron nguyên tử (đầy đủ) của 4 nguyên tố. (1,0 điểm)
X (Z = 12): 1s22s22p63s2
Y (Z = 34): 1s22s22p63s23p63d104s24p4
G (Z = 22): 1s22s22p63s23p63d24s2
H (Z = 29): 1s22s22p63s23p63d104s1
b) Vị trí của X, G trong bảng tuần hoàn. (1,0 điểm)
X: - Ô: 12 (vì Z = 12)
- Chu kì: 3 (vì có 3 lớp e)
- Nhóm: IIA (vì là nguyên tố s và có 2 electron lớp ngoài cùng)
G: - Ô: 22 (vì Z = 22)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IVB (vì là nguyên tố d và có 4 electron hoá trị)
c) Tính chất của 2 nguyên tố Y, H (kim loại, phi kim hay khí hiếm).
Giải thích. (0,5 điểm)
- Y là phi kim, vì có 6e lớp ngoài cùng.
- H là kim loại vì có 1e lớp ngoài cùng.
Câu 2: (1,5 điểm)
a) Xác định loại liên kết: (0,5 điểm)
KCl: Liên kết ion
H2O: Liên kết cộng hoá trị phân cực
N2: Liên kết cộng hoá trị không phân cực
Na2O: Liên kết ion
b) Viết CT electron và công thức cấu tạo của phân tử chứa liên kết cộng hoá trị: N2 và H2O (1,0 điểm)

Câu 3: (3,0 điểm)
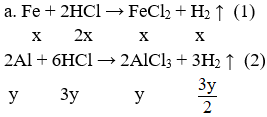
Đặt x, y lần lượt là số mol của Fe và Al
Hệ pt: 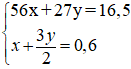
Giải hệ được: x = 0,15 mol; y = 0,3 mol
%Fe = 50,91% và %Al = 49,09%
b. Dung dịch sau phản ứng gồm: FeCl2 0,15 mol; AlCl3 0,3 mol
HCl dư: 1,25 - (2x + 3y) = 0,05 mol
mdd B = mA + mdd HCl – mH = 16,5 + 500 . 1,1 – 0,6 x 2 = 565,3g
C%FeCl2 = 3,37%; C%AlCl3 = 7,08%; C%HCl = 0,32%
c. PTHH:

Để lượng kết tủa không đổi thì KOH cần tối thiểu là vừa đủ để hoà tan hết Al(OH)3. Tổng số mol KOH là: 0,13 + 0,1 + 0,3 + 0,9 + 0,3 = 1,73 mol
Thể tích dung dịch KOH là: 1,73 : 5 = 0,346 lít = 346 ml
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 4)
Bài giảng: Đề thi Học kì 1 Hóa 10 (Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Phần trắc nghiệm
Câu 1: Các hạt cấu tạo nên hầu hết các nguyên tử là:
A. Proton và electron.
B. Proton và nơtron.
C. Proton, nơtron và electron.
D. Nơtron và electron.
Câu 2: Nguyên tố X thuộc chu kỳ 3, nhóm IVA trong bảng tuần hoàn. Cấu hình electron nguyên tử của X là:
A. 1s22s22p63s23p4
B. 1s22s22p63s23p2
C. 1s22s22p63s23p63d104s24p2
D. 1s22s22p63s23p6
Câu 3: Hợp chất X tạo ra oxit cao nhất có công thức là AO2.Trong hợp chất khí với hiđro A chiếm 75% về khối lượng. Nguyên tố A là:
A. C (M = 12) B. Si (M = 28)
C. S (M = 32) &nbsnbsp; D. Cl (M = 35,5)
Câu 4: Nguyên tử của các nguyên tố thuộc chu kì 5 có số lớp electron là:
A. 3 B. 4 C. 5 D. 6
Câu 5: Các nguyên tố 16X, 13Y, 9Z, 8T xếp theo thứ tự tính phi kim tăng dần là:
A. Y, X, Z, T B. Y, X, T, Z.
C. Y, T, Z, X. D. X, T, Y, Z.
Câu 6: Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 2H trong 10 ml nước (biết trong nước chỉ có đồng vị 1H và 2H; khối lượng riêng của nước là 1 g/ml).
A. 5,35. 1020 B. 5,35. 1021
C. 5,35. 1022 D. 5,35. 1023
Câu 7: Chọn cấu hình electron đúng của ion Fe3+ (Z = 26)
A. 1s22s22p63s23p63d5
B. 1s22s22p63s23p63d6
C. 1s22s22p63s23p63d64s2
D. 1s22s22p63s23p63d34s2
Câu 8: Hòa tan hoàn toàn 0,3 gam hỗn hợp hai kim loại X và Y ở hai chu kì liên tiếp của nhóm IA vào nước thì thu được 0,224 lít khí hiđro ở đktc. Hai kim loại đó là (Biết Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133).
A. Li và Na. B. Na và K.
C. K và Rb. D. Rb và Cs.
Câu 9: Trong tự nhiên Bo có 2 đồng vị là 11B (81%) và 10B (19%). Nguyên tử khối trung bình của Bo là:
A. 81 B. 19 C. 10,18 D. 10,81
Câu 10: Hợp chất A được tạo thành từ ion M+ và ion X2- (được tạo ra từ các nguyên tố M và X tương ứng). Trong phân tử A có tổng số các hạt cơ bản là 92, trong đó số hạt mang điện bằng 65,22% tổng số hạt. Số khối của M lớn hơn của X là 7. Nguyên tố M là:
A. Li B. Na C. K D. H
Câu 11: Chất nào sau đây chỉ chứa các liên kết cộng hóa trị?
A. CaCl2. B. Na2O C. KCl D. H2S
Câu 12: Cho dãy chất sau: NH3 , N2O , N2 , HNO3. Số oxi hóa của nitơ trong các chất lần lượt là:
A. -3, 0, +1, +5 B. +3, +1, 0, +6
C. -3, +1, 0, +5 D. -3, +1, +2, +5
Phần tự luận
Câu 1: (1 điểm)
Nguyên tử của một nguyên tố X có tổng số hạt cơ bản là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Tìm số p, e, n và số khối của nguyên tử nguyên tố X.
Câu 2: (3 điểm)
a/ Viết cấu hình e nguyên tử của các nguyên tố X, Y, T, Q trong các trường hợp sau: (1 điểm)
- X có Z = 20.
- Nguyên tử Y có tổng số electron trên phân lớp p là 9.
- Q có Z = 29.
- T có cấu hình electron ion T2-: 1s22s22p6.
b/ Xác định vị trí của nguyên tố X, Q trong bảng tuần hoàn. Giải thích. (1 điểm)
c/ Nêu tính chất hóa học cơ bản của nguyên tố X, Y. Giải thích. (1 điểm).
Câu 3: (3 điểm)
Hòa tan hoàn toàn 13,8 gam hỗn hợp A gồm hai kim loại Fe, Al vào 750 ml dung dịch HCl 1,6M (D = 1,1g/ml) thu được 10,08 lít khí (đktc) và dung dịch B.
a/ Tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp A. (1,5 điểm)
b/ Tính nồng độ phần trăm của các chất trong dung dịch B. (1 điểm)
c/ Nhỏ từ từ dung dịch KOH 15% vào dung dịch B đến khi thu được kết tủa có khối lượng không đổi, lọc lấy kết tủa đem nung ngoài không khí được m gam chất rắn. Tính khối lượng dung dịch KOH và m? (0,5 điểm)
(Cho M của các nguyên tố: Al = 27, Fe = 56, O = 16, H = 1, Cl = 35,5)
Đáp án và Thang điểm
Phần trắc nghiệm
Câu 1. C
Các hạt cấu tạo nên hầu hết các nguyên tử là proton, nơtron và electron.
Câu 2. B
X ở chu kỳ 3 nên X có 3 lớp electron; X thuộc nhóm IVA nên X có 4 electron lớp ngoài cùng. Cấu hình electron của nguyên tử X là: 1s22s22p63s23p2
Câu 3. A
Hợp chất khí với H của A có dạng AH4. Theo bài ra ta có:
→ MA = 12. Vậy A là Cacbon.
Câu 4. C
STT chu kỳ = số lớp electron.
Câu 5. B
Z và T thuộc cùng chu kỳ, có ZZ > ZT → tính phi kim Z > T.
X và Y thuộc cùng chu kỳ, có ZX > ZY → tính phi kim X > Y.
T và X thuộc cùng nhóm, có ZX > ZT → tính phi kim của T > X.
Chiều tăng tính phi kim là: Y < X < T < Z.
Câu 6. B
Gọi % số nguyên tử của hai đồng vị 1H và 2H lần lượt là x và y
Ta có x + y = 100.
Ta lại có:
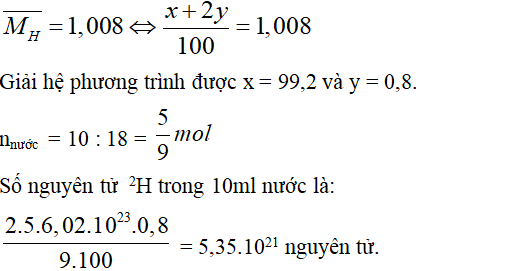
Câu 7. A
Cấu hình electron của Fe là: 1s22s22p63s23p63d64s2
→ Cấu hình electron của Fe3+ là 1s22s22p63s23p63d5
Câu 8. A

Câu 9. D
Nguyên tử khối trung bình của Bo là:
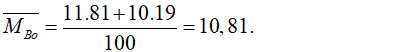
Câu 10. B
Hợp chất A có dạng: M2X
Gọi các hạt proton, nơtron và electron của M trong A lần lượt là pM, nM và eM.
các hạt proton, nơtron và electron của X trong A lần lượt là pX, nX và eX.
Tổng các hạt cơ bản trong A bằng 92
→ 4pM + 2nM + 2pX + nX = 92 (1)
Trong A, số hạt mang điện bằng 65,22% tổng số hạt nên:
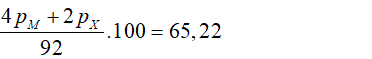
→ 2pM + PX = 30 (2)
Thay (2) vào (1) được 2nM + nX = 32 (3)
Số khối của M lớn hơn số khối của X là 7
→ pM + nM – pX – nX = 7 (4).
Lấy (2) + (3) – (4) ta được: pM + nM = 23.
Vậy M là Na.
Câu 11. D
H2S tạo nên từ hai nguyên tố phi kim → phân tử chứa liên kết cộng hóa trị.
Câu 12. C
Số oxi hóa của N trong NH3, N2O , N2 , HNO3 lần lượt là -3, +1, 0, +5.
Phần tự luận
Câu 1: (1 điểm)
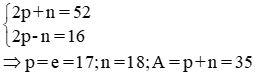
Câu 2: (3 điểm)
a) Cấu hình electron nguyên tử: (1 điểm)
X (Z = 20): 1s22s22p63s23p64s2
Y: 1s22s22p63s23p3
Q (Z = 29): 1s22s22p63s23p63d104s1
T: 1s22s22p4
b) Vị trí của X, Q trong bảng tuần hoàn: (1 điểm)
X: - Ô: 20 (vì Z = 20)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IIA (vì là nguyên tố s và có 2 electron lớp ngoài cùng)
Q: - Ô: 29 (vì Z = 29)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IB (vì là nguyên tố d và có 1 electron hoá trị)
c) Tính chất: (1 điểm)
* X - là kim loại vì có 2e lớp ngoài cùng.
- Hóa trị cao nhất với oxi là II, Hoá trị trong hợp chất khí với hiđro: không có vì là kim loại
- Công thức oxit cao nhất XO ⇒ là oxit bazo; CT hiđroxit tương ứng X(OH)2
⇒ là bazo
* Y - là phi kim vì có 5e lớp ngoài cùng.
- Hóa trị cao nhất với oxi là V, Hoá trị trong hợp chất khí với hiđro là III
- Công thức oxit cao nhất X2O5 ⇒ là oxit axit; CT hiđroxit tương ứng H3XO4
⇒ là axit
- CT hợp chất khí với hiđro là YH3.
Câu 3: (3 điểm)
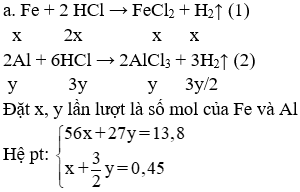
Đặt x, y lần lượt là số mol của Fe và Al
Hệ pt:
Giải hệ được: x = 0,15 mol; y = 0,2 mol
⇒ %Fe = 60,87% và %Al = 39,13%
b. Dd sau phản ứng gồm: FeCl2 0,15 mol; AlCl3 0,2 mol; HCl dư: 1,2 - (2x + 3y) = 0,3 mol
mdd B = mA + mdd HCl – mH2 = 13,8 + 750.1,1 – 0,45.2 = 837,9g
C%FeCl2 = 2,27%; C%AlCl3 = 3,19%; C%HCl = 1,31%
c. PTHH:
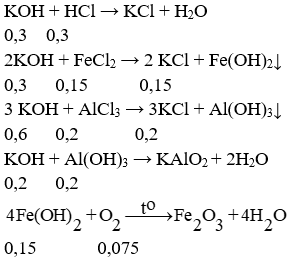
Để lượng kết tủa không đổi thì KOH cần vừa đủ để hoà tan hết Al(OH)3
⇒ Tổng số mol KOH là: 0,3 + 0,3 + 0,6 + 0,2 = 1,4 mol
⇒ Khối lượng dung dịch KOH là: (1,4.56.100) : 15 = 522,67 gam.
⇒ mrắn = 0,075.160 = 12 gam.
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 1
Năm học 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 5)
Câu 1. Tổng số electron ở các phân lớp 3p và 3d của ion 26Fe3+ là
A. 10. B. 11. C. 12. D. 13.
Câu 2. Cấu hình electron của nguyên tử Crom (z = 24) là
A.1s22s22p63s23p64s23d4. B. 1s22s22p63s23p63d44s2.
C.1s22s22p63s23p63d54s1. D. 1s22s22p63s23p64s13d5.
Câu 3. Cho nguyên tố hóa học có kí hiệu 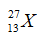
A. 13 hạt proton, 14 hạt nơtron. B. 13 hạt nơtron, 14 hạt proton.
C. 13 hạt proton, 27 hạt nơtron. D. 13 hạt nơtron, 27 hạt proton.
Câu 4. Trong tự nhiên Clo có 2 đồng vị 35Cl và 37Cl. Nguyên tử khối trung bình của Clo là 35,5. Phần trăm về khối lượng của 35Cl trong HClO là (cho nguyên tử khối của H và O lần lượt là 1 và 16)
A. 50,00%. B. 48,67%. C. 51,23%. D. 55,20%.
Câu 5. Biết nguyên tử cacbon gồm: 6 proton, 6 nơtron và 6 electron, khối lượng 1 mol nguyên tử cacbon là
A. 12 u. B. 12 g. C. 18 u. D. 18 g.
Câu 6. Nguyên tử 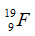
A. 9. B. 10. C. 19. D. 28.
Câu 7. Hạt nhân nguyên tử X có 8 proton và 9 nơtron. Kí hiệu nguyên tử của X là
A. 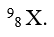
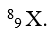
Câu 8. Một nguyên tử có 9 electron ở lớp vỏ, hạt nhân của nó có 10 nơtron. Số hiệu nguyên tử đó là
A. 9. B. 18. C. 19. D. 28.
Câu 9. Nhận định nào không đúng ? Hai nguyên tử 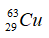
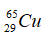
A. là đồng vị của nhau. B. có cùng số electron.
C. có cùng số nơtron. D. có cùng số hiệu nguyên tử.
Câu 10. Kí hiệu nào trong số các kí hiệu của các phân lớp sau là sai?
A. 2s, 4f. B. 1p, 2d. C. 2p, 3d. D. 1s, 2p.
Câu 11. Số electron tối đa trong các lớp L, M lần lượt là
A. 8 và 18. B. 8 và 10. C. 18 và 10. D. 18 và 8.
Câu 12. Số electron tối đa có thể phân bố trên lớp thứ 4 trong vỏ nguyên tử là
A. 16. B. 18. C. 32. D. 50.
Câu 13. Nhận định nào đúng?
A. Tất cả các nguyên tố mà nguyên tử có 4 electron ở lớp ngoài cùng đều là kim loại.
B. Tất cả các nguyên tố mà nguyên tử có 4 electron ở lớp ngoài cùng đều là phi kim.
C. Nguyên tử có1, 2, 3 electron ở lớp ngoài cùng thường là nguyên tử của nguyên tố kim loại.
D. Tất cả các nguyên tố mà nguyên tử có 7 electron ở lớp ngoài cùng đều là kim loại.
Câu 14. Cho các nguyên tử Na, Al, H, K, số proton của chúng lần lượt là 11;13; 1; 19 và số nơtron của chúng lần lượt là 12; 14; 1; 20. Kí hiệu nào không đúng ?
A. 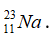
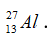
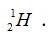
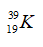
Câu 15. Cấu hình electron nào sau đây viết không đúng?
A. 1s22s2. B. 1s22s22p5.
C. 1s22s22p6. D. 1s22s22p7.
Câu 16. Cho biết cấu hình electron nguyên tử của các nguyên tố sau:
X là 1s1;
Y là 1s2 2s2 2p6 3s1;
Z là 1s2 2s2 2p6 3s2;
T là 1s2 2s2 2p6 3s2 3p3;
Q là 1s2 2s2 2p6 3s2 3p5;
R là 1s2 2s2 2p6 3s2 3p6
Các nguyên tố kim loại là
A. X,Y,Z. B. X,Y,T. C. Z,T,Q. D. T,Q,R.
Câu 17. Nguyên tử X có 3 lớp electron, trong đó lớp ngoài cùng có chứa 5 electron. X có điện tích hạt nhân là
A. 14+. B. 15+. C. 15. D. 18.
Câu 18. Tổng số p, e, n trong nguyên tử của nguyên tố A là 28, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8. Nguyên tố A là
A. O (Z = 8) . B. F (Z = 9). C. Ar (Z =18). D. K (Z = 19).
Câu 19. Trong tự nhiên cacbon có 2 đồng vị bền là 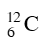
A. 98,9% và 1,1%. B. 49,5% và 51,5%.
C. 99,8% và 0,2%. D. 75% và 25%.
Câu 20. Những nhận định nào không đúng?
1. Trong nguyên tử, số proton bằng số đơn vị điện tích hạt nhân.
2. Tổng số proton và số electron trong nguyên tử bằng số khối.
3. Số khối là khối lượng tuyệt đối của nguyên tử.
4. Trong một nguyên tử, số proton luôn bằng số electron và bằng điện tích hạt nhân.
A. 1,2,3. B. 1,2,4.
C. 1,3,4. D. 2,3,4.
Câu 21: Nguyên tử là phần tử nhỏ nhất của chất:
A. không mang điện.
B. mang điện tích âm.
C. mang điện tích dương.
D. có thể mang điện hoặc không mang điện.
Câu 22: Vỏ nguyên tử là một thành phần của nguyên tử:
A. không mang điện. B. mang điện tích âm.
C. mang điện tích dương. D. có thể mang điện hoặc không.
Câu23. Electron thuộc lớp nào sau đây liên kết với hạt nhân chặt chẽ nhất?
A. Lớp K. B. Lớp L. C. Lớp M. D. Lớp N.
Câu 24. Cấu hình e lớp ngoài cùng của ion X2+ là 3s23p63d6. Cấu hình e của X là
A. 1s22s22p63s23p63d8 B. 1s22s22p63s23p63d4
C. 1s22s22p63s23p63d64s2 D. 1s22s22p63s23p63d44s1
Câu 25. Nguyên tử X có tổng số hạt proton, nơtron, electron là 34. Biết số nơtron nhiều hơn số proton là 1. Số khối của nguyên tử X là
A. 11. B. 23. C. 35. D. 46.
Câu 26: Câu nào sau đây sai?
A. Các đồng vị phải có số khối khác nhau.
B. Các đồng vị phải có số nơtron khác nhau.
C. Các đồng vị phải có cùng điện tích hạt nhân.
D. Các đồng vị phải có số electron khác nhau.
Câu 27. Dãy nào dưới đây gồm các đồng vị của cùng một nguyên tố hóa học?
A. 
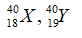
Câu 28. Hạt nhân của nguyên tử 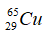
A. 65. B. 29. C. 36. D. 94.
Câu 29: Một nguyên tử Y có tổng số electron ở phân lớp p là 11. Y là nguyên tố hoá học nào trong số các nguyên tố sau?
A. Lưu huỳnh (Z = 16). B. Clo (Z = 17).
C. Flo (Z = 9). D. Kali (Z = 12).
Câu 30. Electron cuối cùng phân bố trong nguyên tử X là 3d8. Số electron lớp ngoài cùng của X là
A. 8. B. 6. C. 4. D. 2.
Hướng dẫn giải:
Câu 1. B
Cấu hình electron nguyên tử Fe là: 1s22s22p63s23p63d64s2
→ Cấu hình electron của ion Fe3+ là: 1s22s22p63s23p63d5
Tổng số electron ở các phân lớp 3p và 3d của ion 26Fe3+ là 6 + 5 = 11.
Câu 2. C
Câu 3. A
Số proton = z = 13.
Số nơtron = A – z = 27 - 13 = 14.
Câu 4. A
Gọi % số nguyên tử của hai đồng vị 35Cl và 37Cl lần lượt là x và y mol.
Theo bài ra ta có:
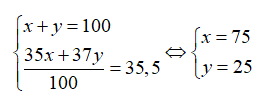
Giả sử có 1 mol HClO → Số mol Cl trong HClO là 1; số mol 35Cl là 0,75 mol
Phần trăm về khối lượng của 35Cl trong HClO là
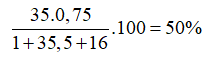
Câu 5. B
Khối lượng của 1 nguyên tử C là: 6u + 6u + 0,00055u = 12u.
Khối lượng 1 mol nguyên tử C là: 12.1,6605.10-27.1000. 6,02.1023 =12g.
Câu 6. C
Chỉ số phía trên bên trái kí hiệu nguyên tử là số khối.
Câu 7. B
Số hiệu nguyên tử X = số p = 8.
Số khối của nguyên tử X là A = z + n = 8 + 9 = 17.
Vậy kí hiệu nguyên tử là : 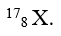
Câu 8. A
Số hiệu nguyên tử = số p = số e = 9.
Câu 9. C
Số nơtron của 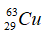
Số nơtron của 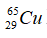
Câu 10. B
Không có phân lớp 1p và 2d.
Câu 11. A
Lớp L là lớp thứ 2, có số e tối đa là 2.22 = 8.
Lớp M là lớp thứ 3, có số e tối đa là 2.32 = 18.
Câu 12. C
Số electron trên lớp thứ 4 là 2.42 = 32.
Câu 13. C
Câu 14. C
Kí hiệu đúng là 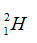
Câu 15. D
Số electron tối đa trên phân lớp p là 6.
Câu 16. A
Nguyên tử có 1,2,3 electron lớp ngoài cùng thường là nguyên tử của nguyên tố kim loại.
Ta có: X, Y có 1 e lớp ngoài cùng, Z có 2 e lớp ngoài cùng, T có 5 e lớp ngoài cùng, Q có 7 e lớp ngoài cùng và R có 8 e lớp ngoài cùng.
Vậy X, Y, Z là nguyên tử của nguyên tố kim loại.
Câu 17. B
Cấu hình electron của X là [Ne]3s23p3 → điện tích hạt nhân X là 15+.
Câu 18. B
Theo bài ra ta có hệ phương trình:
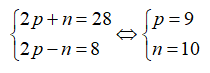
Số hiệu nguyên tử của A là 9, vậy A là Flo.
Câu 19. A
Gọi % của đồng vị 
Ta có
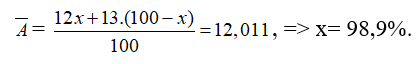
Câu 20. D
2 sai vì số khối bằng tổng của số p và số e.
3 sai vì số khối là khối lượng tương đối của nguyên tử.
4 sai vì trong một nguyên tử, số proton luôn bằng số electron và bằng số đơn vị điện tích hạt nhân.
Câu 21. A
Câu 22. B
Câu 23. A
Lớp K là lớp thứ 1, gần hạt nhân nhất nên liên kết với hạt nhân chặt chẽ nhất.
Câu 24. C
Câu 25. B
Gọi số hạt proton, nơtron, electron trong X lần lượt là p, n và e.
Theo bài ra ta có hệ phương trình :
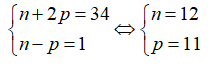
Vậy số khối của nguyên tử X là 11 + 12 = 23.
Câu 26. D
Câu 27. C
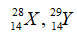
Câu 28. C
Số n = A – z = 65 – 29 = 36.
Câu 29. B
Cấu hình electron của Y là: 1s22s22p63s23p5
→ Số hiệu nguyên tử Y = số electron = 17. Vậy Y là Cl.
Câu 30. D
Cấu hình electron của X là 1s22s22p63s23p63d84s2. Vậy X có 2 electron lớp ngoài cùng.

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 1
Năm học 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 6)
Câu 1: Trong tự nhiên H có 3 đồng vị: 1H, 2H, 3H. Oxi có 3 đồng vị 16O, 17O, 18O. Hỏi có bao nhiêu loại phân tử H2O được tạo thành từ các loại đồng vị trên?
A. 3. B. 16. C. 18. D. 9.
Câu 2: Hạt nhân của hầu hết các nguyên tử do các loại hạt sau cấu tạo nên
A. electron, proton và nơtron. B. electron va nơtron.
C. proton và nơtron. D. electron và proton.
Câu 3: Một nguyên tử được đặc trưng cơ bản bằng
A. Số proton và điện tích hạt nhân. B. Số proton và số electron.
C. Số khối A và số nơtron. D. Số khối A và điện tích hạt nhân.
Câu 4: Nguyên tử có số e là 13 thì cấu hình lớp ngoài cùng là
A. 3p14s2. B. 2s22p1. C. 3s23p2. D. 3s23p1.
Câu 5: Trong nguyên tử X các e được phân bố trên 3 lớp, lớp thứ 3 có 8e. Điện tích hạt nhân của nguyên tử X là
A. 16+. B. 10+. C. 18+. D. 8+.
Câu 6: Ở phân lớp 3d số electron tối đa là
A. 14. B. 10. C. 6. D. 18.
Câu 7: Có bao nhiêu electron trong ion 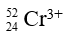
A. 21. B. 27. C. 24. D. 49.
Câu 8: Nguyên tử M có cấu hình ở phân mức năng lượng cao nhất là 3d7. Tổng số e trong nguyên tử M là
A. 28. B. 27. C. 26. D. 29.
Câu 9: Nguyên tố hóa học bao gồm các nguyên tử:
A. Có cùng số khối A. B. Có cùng số proton.
C. Có cùng số nơtron. D. Có cùng số proton và số nơtron.
Câu 10: Cho số hiệu nguyên tử của cacbon, nitơ, oxi và flo lần lượt là 6, 7, 8, 9 và số khối của chúng lần lượt là 12, 14, 16, 19. Xét kí hiệu nào sau đây viết sai?
A. 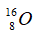
Câu 11: Kí hiệu nào trong số các kí hiệu của các phân lớp sau là sai?
A. 1p, 2d. B. 1s, 2p. C. 2p, 3d. D. 2s, 4f.
Câu 12: A có điện tích hạt nhân là 25. Vậy A là?
A. Nguyên tố d. B. Nguyêt tố f. C. Nguyên tố p. D. Nguyên tố s.
Câu 13: Cho nguyên tử: 
A. 1s22s22p63s23p64s13d2 B. 1s22s22p63s23p63d3
C. 1s22s22p63s23p64s23d1 D. 1s22s22p63s23p63d14s2
Câu 14: Cho 2 kí hiệu nguyên tử: 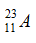
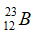
A. A và B có cùng điện tích hạt nhân. B. A và B cùng có 23 electron.
C. A và B là đồng vị của nhau. D. Hạt nhân của A và B đều có 23 hạt.
Câu 15: Chọn đáp án đúng?
A. Khối lượng riêng của hạt nhân lớn hơn khối lượng riêng của nguyên tử.
B. Bán kính nguyên tử bằng tổng bán kính e, p, n.
C. Trong nguyên tử các hạt p, n, e xếp khít nhau thành một khối bền chặt.
D. Bán kính nguyên tử bằng bán kính hạt nhân.
Câu 16: Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 8. Số đơn vị điện tích hạt nhân của A và B là
A. 13 và 17. B. 13 và 21. C. 15 và 19. D. 15 và 23.
Câu 17: Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 0,53125 số hạt mang điện. Điện tích hạt nhân của X là
A. 18+. B. 17+. C. 15+. D. 16+.
Câu 18: Trong nguyên tử một nguyên tố A có tổng số các loại hạt là 58. Biết số hạt proton ít hơn số hạt nơtron là 1 hạt. Kí hiệu của A là
A. 
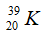
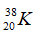
Câu 19: Các đồng vị được phân biệt bởi yếu tố nào sau đây?
A. Số electron hoá trị. B. Số nơtron.
C. Số proton. D. Số lớp electron.
Câu 20: Nguyên tố X có số hiệu nguyên tử là 29. Cấu hình e của X là
A. 1s22s22p63s23p64s23d9. B. 1s22s22p63s23p63d104s1.
C. 1s22s22p63s23p63d94s2. D. 1s22s22p63s23p64s13d10.
Câu 21: Dựa vào thứ tự mức năng lượng, xét xem sự xắp xếp các phân lớp nào sau đây sai?
A. 3d < 4s. B. 3p < 3d. C. 1s < 2s. D. 4s > 3s.
Câu 22: Tổng số hạt cơ bản trong một nguyên tử 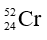
A. 28. B. 24. C. 76. D. 52.
Câu 23: Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị có % về số nguyên tử tương ứng là 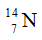
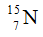
A. 14,7. B. 14,0. C. 14,4. D. 13,7.
Câu 24: Điều khẳng định nào là sai?
A. Số đơn vị điện tích hạt nhân luôn bằng số proton.
B. Số proton luôn lớn hơn số nơtron.
C. Số proton luôn bằng số electron.
D. Số nơtron luôn lớn hơn hoặc bằng số proton.
Câu 25: Tổng số hạt n, p, e trong một nguyên tử X là 52, trong đó số hạt mang điện bằng 1,889 lần số hạt không mang điện. Kết luận nào không đúng?
A. X có 5 e ở lớp ngoài cùng. B. X là phi kim.
C. X có số khối A là 35. D. X có điện tích hạt nhân X là 17.
Câu 26. Trong nguyên tử, hạt không mang điện là
A. nơtron và proton. B. proton. C. electron. D. nơtron.
Câu 27. Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
A. Hạt nhân có cùng số nơtron nhưng khác nhau về số proton.
B. Hạt nhân có cùng số proton nhưng khác nhau về số nơtron.
C. Hạt nhân có cùng số nơtron nhưng khác nhau về số electron.
D. Hạt nhân có cùng số proton và số electron.
Câu 28. Cho hai nguyên tố M và N có số hiệu nguyên tử lần l¬ượt là 11 và 13. Cấu hình electron của M và N lần l¬ượt là
A. 1s22s22p7 và 1s22s22p63s2.
B. 1s22s22p63s1 và 1s22s22p63s23p1.
C. 1s22s22p63s1 và 1s22s22p63s2.
D. 1s22s22p63s1 và 1s22s22p63s3.
Câu 29. Ở nhiệt độ 20oC, khối lượng riêng của kim loại X bằng 10,48 g/cm3 và bán kính nguyên tử X là 1,446.10-8 cm. Giả thiết trong tinh thể các nguyên tử X có dạng hình cầu và có độ rỗng là 26%. Biết số Avogađro NA = 6,022.1023. Kim loại X là
A. Fe. B. Cu. C. Ag. D. Cr.
Câu 30. Đặc điểm của electron là
A. mang điện tích dương.
B. mang điện tích âm.
C. không mang điện.
D. trung hòa về điện.
Hướng dẫn giải:
Câu 1. C
- Với 16O có thể tạo nên các phân tử nước với 3 đồng vị của H là:
1H16O1H; 2H16O2H; 3H16O3H; 1H16O2H ; 1H16O3H; 2H16O3H.
- Với 17O có thể tạo nên các phân tử nước với 3 đồng vị của H là:
1H17O1H; 2H17O2H; 3H17O3H; 1H17O2H ; 1H17O3H; 2H17O3H.
- Với 18O có thể tạo nên các phân tử nước với 3 đồng vị của H là:
1H18O1H; 2H18O2H; 3H18O3H; 1/H18O2H ; 1H18O3H; 2H18O3H.
Câu 2. C
Câu 3. D
Câu 4. D
Cấu hình electron của nguyên tử đó là: [Ne]3s23p1.
→ Cấu hình electron lớp ngoài cùng là: 3s23p1.
Câu 5. C
Cấu hình electron của X là: 1s22s22p63s23p6
Số hiệu nguyên tử X = số electron = 18.
Điện tích hạt nhân X là 18+.
Câu 6. B
Câu 7. A
Crom có p = e = 24 hạt, Cr3+ có e = 21 (do Cr3+ đã nhường 3 e).
Câu 8. B
Cấu hình electron của M là: 1s22s22p63s23p63d74s2
→ Tổng số electron của nguyên tử M là 27.
Câu 9. B
Câu 10. D
Kí hiệu đúng là 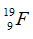
Câu 11. A
Không có phân lớp 2d.
Câu 12. A
Trật tự phân mức năng lượng: 1s22s22p63s23p64s23d5
Electron cuối cùng được điền vào phân lớp d theo trật tự phân mức năng lượng. Vậy A là nguyên tố d.
Câu 13. D
Câu 14. D
A sai vì điện tích của hạt nhân A là 11+, điện tích của hạt nhân B là 12+.
B sai vì A có 11 electron và B có 12 electron.
C sai vì A và B có số proton khác nhau nên không là đồng vị của nhau.
Câu 15. A
Câu 16. A
Cấu hình electron của A là 1s22s22p63s23p1
→ Số đơn vị điện tích hạt nhân của A là 13.
Số hạt mang điện trong A là 13.2 = 26 → Số hạt mang điện trong B là 26 + 8 = 34.
→ Số đơn vị điện tích hạt nhân của B là 34 : 2 = 17.
Câu 17. D
Gọi số hạt proton, nơtron và electron trong X lần lượt là p, n và e.
Theo bài ra ta có:
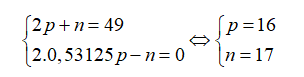
Điện tích hạt nhân nguyên tử X là 16+.
Câu 18. B
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố A là 58:
p + e + n = 58 hay 2p + n = 58 (do p = e) (1)
Số hạt p ít hơn số hạt n là 1 hạt:
n- p =1 (2)
Giải (1), (2) ta có p = e = 19, n = 20
Vậy A có số hiệu nguyên tử = số p = 19; Số khối của A là 19 + 20 = 39.
→ Kí hiệu nguyên tử A là: 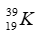
Câu 19. B
Câu 20. B
Câu 21. A
Mức năng lượng ở phân lớp 3d > 4s.
Câu 22. C
Tổng số hạt cơ bản trong Cr = p + n + e = A + e = 52 + 24 = 76.
Câu 23. B
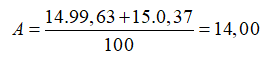
Câu 24. B
Câu 25.
Theo bài ra ta có hệ phương trình:
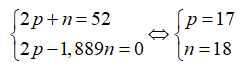
Cấu hình electron của X là [Ne]3s23p5 → X có 7e lớp ngoài cùng nên là phi kim.
Số khối của X là: 18 + 17 = 35.
Điện tích hạt nhân X là 17+.
Câu 26. D
Câu 27. B
Câu 28. B
Câu 29. C
Thể tích 1 nguyên tử X là: 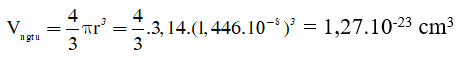
Thể tích nguyên tử (phần đặc) trong 1cm3 tinh thể là: 1.(100%-26%) = 0,74cm3
1cm3 tinh thể có số nguyên tử là: 0,74 : (1,27.10-23) = 5,85.1022 nguyên tử.
Khối lượng 1 nguyên tử: 10,48 : (5,85.1022) = 1,79.10-22 (g)
Khối lượng 1 mol nguyên tử: 1,79.10-22 .6,022.1023 = 108 g/mol
→ X là Ag.
Câu 30. B
Electron mang điện tích âm.
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 1
Năm học 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 7)
Câu 1. Cho nguyên tố X, nguyên tử của nó có cấu hình electron là: 1s22s22p63s23p63d54s2. X thuộc nguyên tố
A. s . B. f.
C. d. D. p.
Câu 2. Hạt nhân nguyên tử 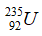
A. 143. B. 145. C. 235. D. 92.
Câu 3: Trong tự nhiên, Clo có 2 đồng vị 35Cl và 37Cl, trong đó đồng vị chiếm 35Cl 75% về số đồng vị. Nguyên tử khối trung bình của Cl là
A. 35,54. B. 35,50. C. 36,5. D. 35,6.
Câu 4: Có các đồng vị sau 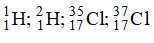
A. 3. B. 2. C. 4. D. 6.
Câu 5: Các electron của nguyên tử nguyên tố R được phân bố trên 4 lớp, lớp ngoài cùng có 2 electron, số phân lớp có chứa electron của R là 6. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố R có thể là giá trị nào
A. 19. B. 34.
C. 28. D. 20.
Câu 6. Nguyên tử của nguyên tố A có tổng số electron ở các phân lớp p là 9. Nguyên tố A là
A. 15P. B. 17Cl. C. 14Si. D. 16S.
Câu 7: Một nguyên tử M có 96 proton, 151 nơtron. Kí hiệu nguyên tử M là
A. 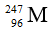
B. 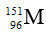
C. 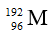
D. 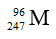
Câu 8: Cho 3 nguyên tử: 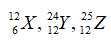
A. X, Y và Z. B. Y và Z.
C. X và Z. D. X và Y.
Câu 9: Argon tách ra từ không khí là hỗn hợp của 3 đồng vị: 40 Ar (99,6%); 38 Ar (0,063%); 36 Ar (0,337%). Nguyên tử khối trung bình của Ar là
A. 39,99. B. 39,87. C. 38,89. D. 38,52.
Câu 10: Tổng số khối của 2 đồng vị X, Y là 72 trong đó có 38 hạt không mang điện. X, Y là các đồng vị của nguyên tố
A. 17Cl. B. không xác định được .
C. 16S. D. 19K .
Câu 11: Tổng số hạt (e, p, n) trong phân tử MX là 108 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36. Số khối của M nhiều hơn số khối của X là 8 đơn vị. Số hạt trong M2+sub> lớn hơn số hạt trong X2− là 8 hạt. % khối lượng của M có trong hợp chất là
A. 44,44%. B. 71,43%.
C. 28,57%. D. 55,56%.
Câu 12: Đồng vị là những nguyên tử có cùng số proton nhưng khác nhau về
A. số electron. B. điện tích hạt nhân.
C. số nơtron. D. số đơn vị điện tích hạt nhân.
Câu 13: Cation X+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Kết luận sai là
A. X là nguyên tố kim loại.
B. hạt nhân nguyên tử X có 11 proton.
C. lớp ngoài cùng của X có 5 electron.
D. X nằm ở chu kì 3 trong bảng tuần hoàn.
Câu 14. Nguyên tử M có 7 electron ở phân lớp 3d. Số hạt mang điện của nguyên tử M là
A. 29. B. 54. C. 27. D. 25.
Câu 15. Các phân lớp có trong lớp M là
A. 3s; 3p; 3d. B. 3s; 3p; 3d; 3f. C. 4s; 4p; 4d; 4f. D. 2s; 2p.
Câu 16: Khối lượng riêng của kim loại canxi là 1,55 g/cm3. Khối lượng mol của nguyên tử canxi là 40 g/mol. Trong tinh thể canxi, các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử canxi tính theo lí thuyết là
A. 0,196 nm. B. 0,185 nm.
C. 0,168 nm. D. 0,155nm.
Câu 17: Trong nguyên tử hạt mang điện tích âm là
A. electron. B. proton .
C. notron . D. electron và proton.
Câu 18: Tổng số hạt của nguyên tử X là 155. Số hạt mang điện nhiều hơn số hạt không mang điện là 33. Số khối của nguyên tử X là
A. 155. B. 66. C. 122. D. 108.
Câu 19: Trong nguyên tử 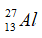
A. 14 hạt. B. 13 hạt .
C. 27 hạt. D. 12 hạt.
Câu 20: Nguyên tử photpho có 15 proton, 16 nơtron và 15 electron, khối lượng của 1 nguyên tử photpho là
A. 31u. B. 30g. C. 46u. D. 31g.
Câu 21: Cho nguyên tử 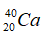
A. 20p, 20e và 40n. B. 40e, 20p và 20n.
C. 20e, 40p và 20n. D. 20p, 20e và 20n.
Câu 22: Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
A. proton. B. nơtron và electron.
C. nơtron. D. electron.
Câu 23. Cấu hình electron nào sau đây là của nguyên tố kim loại
A. 1s22s22p63s2. B. 1s22s22p4.
C. 1s2. D. 1s22s22p6 .
Câu 24: Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là
A. 2, 6, 10, 14. B. 2, 6, 8, 18.
C. 2, 4, 6, 8. D. 2, 8, 18, 32.
Câu 25: Y là nguyên tố d có 4 lớp electron và có 3 electron ở mức năng lượng cao nhất. Số hiệu nguyên tử của nguyên tố Y là
A. 33. B. 21. C. 23. D. 31.
Câu 26: Nguyên tử khối trung bình của Vanadi (V) là 50,94. V có hai đồng vị, trong đó 50V chiếm 6%. Số khối đồng vị thứ hai là
A. 49. B. 51 C. 52. D. 50.
Câu 27: Số electron tối đa trong lớp 2 là
A. 8 B. 18 C. 32 D. 2
Câu 28: Cho kí hiệu nguyên tử 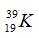
A. Trong nhân có 38 hạt mang điện.
B. Số hiệu nguyên tử là 39.
C. K+ có 3 lớp electron.
D. Số nơtron trong hạt nhân hơn số proton là 2.
Câu 29: Trong các cấu hình electron dưới đây cấu hình không đúng là
A. 1s22s22p63s23p6 B. 1s22s22p63s23p63d54s2
C. 1s22s22p63s23p54s2 D. 1s22s22p63s2.
Câu 30: Một ion có 18 electron và 19 protron mang điện tích là
A. 18-. B. 1+.
C. 1-. D. 19+.
Hướng dẫn giải:
Câu 1. C
Theo trật tự phân mức năng lượng, electron cuối cùng được điền vào phân lớp d.
X thuộc nguyên tố d.
Câu 2. A
Số n = 235 – 92 = 143.
Câu 3. B
Nguyên tử khối trung bình của Cl là :
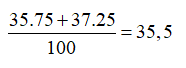
Câu 4. C
Có thể tạo ra các phân tử là: 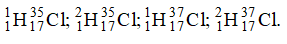
Câu 5. D
Cấu hình electron của R là: 1s22s22p63s23p64s2
→ Số đơn vị điện tích hạt nhân của R bằng số electron = 20.
Câu 6. A
Cấu hình electron nguyên tử A là: 1s22s22p63s23p3 → A là P.
Câu 7. A
Số khối của M là A = 96 + 151 = 247.
Số hiệu nguyên tử M là z = số p = 96.
Kí hiệu nguyên tử M là: 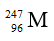
Câu 8. B
Y và Z có cùng số p là 12 nên là đồng vị của nhau.
Câu 9. A
Nguyên tử khối trung bình của Ar là:
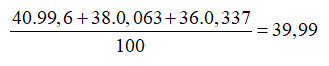
Câu 10. A
Gọi số proton và nơtron của X là px và nx; proton và nơtron của Y là py và ny.
Trong đó px = py = p.
Theo bài ra ta có:
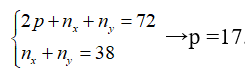
Câu 11. D
Gọi số proton, nơtron và electron tron M lần lượt là pM, nM và eM.
số proton, nơtron và electron tron X lần lượt là px, nx và ex.
Trong đó pM = eM và px = e x.
Có tổng số hạt trong phân tử MX là 108 → 2pM + nM + 2pX + nX = 108 (1)
Trong MX, số hạt mang điện nhiều hơn số hạt không mang điện là 36
→ 2pM + 2pX – (nM + nX ) = 36 (2)
Từ (1) và (2) có pM + pX = 36 và nM + nX = 36 (1‘)
Số khối của M nhiều hơn số khối của X là 8 → pM + nM – pX - nX = 8 (3)
Số hạt trong M2+ lớn hơn số hạt trong X2− là 8 hạt
→ 2pM + nM – 2 - (2px + nX + 2) = 8 → 2pM + nM -2px – nX = 12 (4)
Từ (3) và (4) có pM – pX = 4 và nM – nX = 4 (2’)
Từ (1‘) (2’) có pM= 20 ; pX = 16; nM= 20 và nX = 16.
Coi khối lượng nguyên tử xấp xỉ số khối có:
MM = 20 + 20 = 40; MX = 16 + 16 = 32.
% khối lượng của M có trong hợp chất là
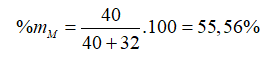
Câu 12. C
Câu 13. C
Cấu hình electron của ion X+ là 1s22s22p6
→ Cấu hình electron của X là: 1s22s22p63s1
X có 1 electron lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
Câu 14. B
Cấu hình electron nguyên tử M là: 1s22s22p63s23p63d74s2
→Trong M, Số electron = số proton = 27.
Số hạt mang điện của M là 27.2 = 54.
Câu 15. A
Lớp M là lớp thứ 3. Các phân lớp có trong lớp thứ 3 là: 3s; 3p; 3d.
Câu 16. A
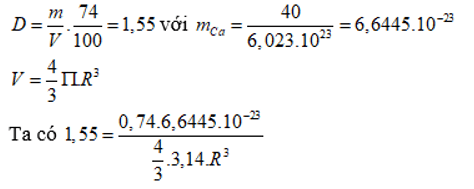
→ R = 1,96.10-8 (cm) = 0,196nm.
Câu 17. A
Câu 18. D
Gọi số hạt proton, nơtron và electron trong X lần lượt là: p, n và e.
Theo bài ra ta có:
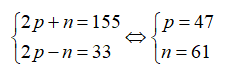
Số khối của X là 47 + 61 = 108.
Câu 19. D
Số hạt mang điện trong Al = số p + số e = 2z = 13.2 =26.
Số hạt không mang điện trong Al = số nơtron = A – z = 27 – 13 = 14.
Số hạt mang điện nhiều hơn số hạt không mang điện là 26 – 14 = 12.
Câu 20. A
Khối lượng P là 15u + 16u + 15. 0,00055u = 31u.
Câu 21. D
Số p = số e = z = 20.
Số n = A – z = 40 – 20 = 20.
Câu 22. D
Câu 23. A
Nguyên tử có 1,2,3 electron lớp ngoài cùng là nguyên tử của nguyên tố kim loại trừ H, He, Bo.
A. 1s22s22p63s2 → 2 e lớp ngoài cùng → là kim loại.
C. 1s2 → 2 e lớp ngoài cùng, chu kỳ 1 → là khí hiếm He.
Câu 24. A
Câu 25. C
Cấu hình electron của Y là 1s22s22p63s23p63d34s2
→ Số electron của Y là 23 → Số hiệu nguyên tử Y là 23.
Câu 26. B
Gọi số khối của đồng vị thứ 2 là x. Ta có:
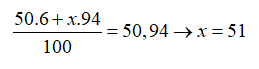
Câu 27. A
Số electron tối đa trong lớp thứ 2 là 2.22 = 8.
Câu 28. C
Từ kí hiệu nguyên tử xác đinh được số khối A = 39, số p = số e = z = 19.
A sai vì số hạt mang điện trong hạt nhân = số p = 19.
B sai vì số hiệu nguyên tử = 19.
C đúng vì cấu hình electron của K+ là 1s22s22p63s23p6 → có 3 lớp e.
D sai vì số n = 39 – 19 = 20 hơn số proton là 1.
Câu 29. C
Phân lớp 3p chưa bão hòa.
Câu 30. B
Ion có số proton lớn hơn số electron nên mang điện tích dương.
Số đơn vị điện tích của ion là 19 – 18 = 1.
Vậy điện tích của ion là 1+.

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 1
Năm học 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 8)
Câu 1: Số electron tối đa của các phân lớp s, p, d, f lần lượt là?
A. 1; 3; 5; 7. B. 1; 2; 3; 4.
C. 2; 6; 10; 14. D. 2; 4; 6; 8.
Câu 2: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron, nơtron, proton. B. electron, proton.
C. nơtron, electron. D. proton, nơtron.
Câu 3: Nguyên tử O (Z = 8) nhận thêm 2e thì cấu hình e tương ứng của nó là
A. 1s22s22p63s1. B. 1s22s22p6.
C. 1s22s22p63s23p6. D. 1s22s22p4.
Câu 4: Cho cấu hình electron của Al (Z = 13): 1s22s22p63s23p1. Hỏi Al thuộc loại nguyên tố gì?
A. Nguyên tố d. B. Nguyên tố s. C. Nguyên tố f. D. Nguyên tố p.
Câu 5: Trong tự nhiên Kali có ba đồng vị: 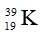
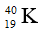
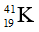
A. 0,484% và 6,258%. B. 0,012% và 6,73% .
C. 0,484% và 6,73%. D. 0,012% và 6,258%.
Câu 6: Ở trạng thái cơ bản S (Z = 16) có bao nhiêu electron ở phân lớp ngoài cùng?
A. 1. B. 2. C. 3. D. 4.
Câu 7: Trong tự nhiên, Clo có 2 đồng vị 35Cl và 37Cl, trong đó đồng vị chiếm 35Cl 75% về số đồng vị. Phần trăm khối lượng của 35Cl trong KClO4 là (cho nguyên tử khối: K=39, O=16)
A. 21,43%. B. 7,55%. C. 18,95%. D. 64,29%.
Câu 8: Số e tối đa trong phân lớp p là
A. 2. B. 10. C. 6. D. 14.
Câu 9: Nguyên tử Na (Z = 11) bị mất đi 1e thì cấu hình e tương ứng của nó là
A. 1s22s22p63s23p64s1. B. 1s22s22p63s1.
C. 1s22s22p6. D. 1s22s22p63s3.
Câu 10: Nguyên tử của nguyên tố nào sau đây có số hạt nơtron nhỏ nhất ?
A. 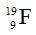
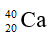
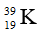
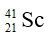
Câu 11: Ở trạng thái cơ bản,cấu hình electron nguyên tử nitơ (Z = 7) có bao nhiêu phân lớp?
A. 3. B. 5. C. 1. D. 2.
Câu 12: Cho Mg có hai đồng vị 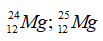
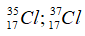
A. 6. B. 4. C. 8. D. 12.
Câu 13: Đồng có hai đồng vị 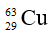
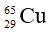
A. Cấu hình electron. B. Số electron.
C. Số proton. D. Số khối.
Câu 14: Nguyên tử Ca (Z = 20) có số e ở lớp ngoài cùng là
A. 6. B. 2. C. 10. D. 8.
Câu 15: Nguyên tử X có tổng số hạt proton, nơtron và electron là 115. Ngoài ra số khối của X là 80. Số lớp electron và số electron lớp ngoài của X cùng lần lượt là
A. 3 & 7. B. 4 & 7. C. 4 & 1. D. 3 & 5.
Câu 16: Chọn câu phát biểu sai?
A. Trong 1 nguyên tử số proton = số electron = số đơn vị điện tích hạt nhân.
B. Số khối bằng tổng số hạt proton và số nơtron.
C. Số proton bằng số electron.
D. Tổng số proton và số electron được gọi là số khối.
Câu 17: Cho nguyên tử nguyên tố X có 12 proton và 12 nơtron. Kí hiệu nguyên tử đúng của X là?
A. 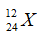
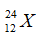
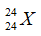
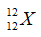
Câu 18: Các hạt cấu tạo nên nguyên tử của hầu hết các nguyên tố là
A. proton, nơtron. B. electron, proton.
C. nơtron, electron. D. electron, nơtron, proton.
Câu 19: Cho cấu hình electron của Fe (Z = 26): 1s22s22p63s23p63d64s2 . Hỏi Fe thuộc loại nguyên tố gì?
A. Nguyên tố s. B. Nguyên tố d. C. Nguyên tố f. D. Nguyên tố p.
Câu 20: Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 5e. Vậy số hiệu nguyên tử của nguyên tố R là
A. 19. B. 16. C. 14. D. 15.
Câu 21: Một nguyên tố X có 2 đồng vị có tỉ lệ số nguyên tử là 27/23. Hạt nhân của X có 35 proton. Đồng vị thứ nhất có 44 nơtron. Đồng vị thứ hai có nhiều hơn đồng vị thứ nhất là 2 nơtron. Nguyên tử khối trung bình của nguyên tố X là
A. 78,90. B. 79,20. C. 79,92. D. 80,5.
Câu 22: Trong tự nhiên, nguyên tố đồng có hai đồng vị là 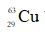
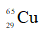
A. 27%. B. 50%. C. 73%. D. 54%.
Câu 23: Có các nguyên tố hóa học: Cr (Z = 24), Fe (Z = 26), P (Z = 15), Al (Z = 13). Nguyên tố mà nguyên tử của nó có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là
A. Al. B. Fe. C. Cr. D. P.
Câu 24: Cấu hình electron nào sau đây là của kim loại
A. 1s22s22p63s23p5 . B. 1s22s22p63s23p4 .
C. 1s22s22p63s23p6. D. 1s22s22p63s2.
Câu 25: Có 3 nguyên tử: 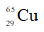
A. X & Y. B. Y & Z. C. X & Z. D. X,Y & Z.
Câu 26. Trong nguyên tử, hạt không mang điện là
A. nơtron và proton B. proton C. electron D. nơtron
Câu 27. Ion có 18 electron và 16 proton mang điện tích là
A. 16+. B. 2−. C. 18−. D. 2+.
Câu 28. Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết
A. số khối A B. số hiệu nguyên tử Z
C. nguyên tử khối của nguyên tử D. số khối A và số hiệu nguyên tử Z
Câu 29. Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
A. Hạt nhân có cùng số nơtron nhưng khác nhau về số proton.
B. Hạt nhân có cùng số proton nhưng khác nhau về số nơtron.
C. Hạt nhân có cùng số nơtron nhưng khác nhau về số electron.
D. Hạt nhân có cùng số proton và số electron.
Câu 30. Trên vỏ nguyên tử, các electron chuyển động xung quanh hạt nhân................ Hãy chọn cụm từ thích hợp đối với chỗ trống ở trên.
A. với vận tốc rất lớn trên những quỹ đạo xác định
B. với vận tốc rất lớn không theo quỹ đạo xác định
C. một cách tự do
D. với vận tốc rất lớn có quỹ đạo hình elip hay hình tròn
Hướng dẫn giải:
Câu 1. C
Câu 2. D
Câu 3. B
Cấu hình electron của Oxi: 1s22s22p4.
Sau khi O nhận thêm 2e được ion có cấu hình electron là: 1s22s22p6.
Câu 4. D
Theo trật tự phân mức năng lượng, electron cuối cùng được điền vào phân lớp p.
Câu 5. A
Theo bài ra ta có hệ phương trình:
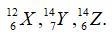
Câu 6. D
Cấu hình electron của S là: [Ne]3s23p4 → Số electron ở phân lớp ngoài cùng là 4.
Câu 7. C
Nguyên tử khối trung bình của Cl là :
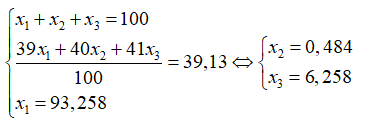
Giả sử có 1 mol KClO4 → Số mol Cl = 1; số mol 35Cl là 0,75.
Phần trăm khối lượng của 35Cl trong KClO4 là
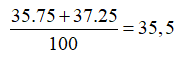
Câu 8. C
Câu 9. C
Cấu hình electron của Na là [Ne]3s1. → Cấu hình electron của Na khi mất 1 electron là : 1s22s22p6.
Câu 10. A
Số nơtron của F là 19 – 9 = 10.
Số nơtron của Ca, K và Sc đều là 20.
Câu 11. A
Cấu hình electron của N là: 1s22s22p3. Vậy cấu hình electron nguyên tử N gồm 3 phân lớp.
Câu 12. A
Các công thức có thể có là: 24Mg35Cl2; 24Mg37Cl2; 24Mg35Cl37Cl; 25Mg35Cl2; 25Mg37Cl2; 25Mg35Cl37Cl;
Câu 13. D
Câu 14. B
Cấu hình electron nguyên tử Ca là: [Ar]4s2. Vậy số e lớp ngoài cùng là 2.
Câu 15. B
Gọi số proton, nơtron và electron trong X lần lượt là p, n và e.
Theo bài ra ta có hệ phương trình:
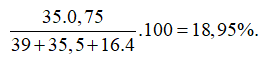
Cấu hình electron nguyên tử X là: [Ar]3d104s24p5. Vậy X có 4 lớp electron và 7electron lớp ngoài cùng.
Câu 16. D
Số khối bằng tổng số hạt proton và số nơtron.
Câu 17. B
Số khối A = 12 + 12 = 24.
Số hiệu nguyên tử Z = số proton = 12.
Kí hiệu nguyên tử là 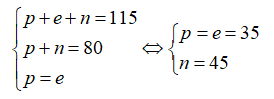
Câu 18. D
Câu 19. B
Theo trật tự phân mức năng lượng, electron cuối cùng điến vào phân lớp d.
Câu 20. D
Cấu hình electron của R là [Ne]3s23p3.
Vậy số hiệu nguyên tử của R = số electron của R = 15.
Câu 21. C
Số khối của đồng vị thứ nhất là: 79
Số khối của đồng vị thứ hai là: 79 + 2 = 81.
Một cách gần đúng, coi số khối xấp xỉ nguyên tử khối.
Nguyên tử khối trung bình của X là: 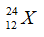
Câu 22. A
Gọi x và y lần lượt là % số nguyên tử của hai đồng vị và .
Ta có:
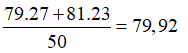
Câu 23.
Ta có cấu hình electron nguyên tử của các nguyên tố là:
Cr: [Ar]3d54s1 → 1e lớp ngoài cùng.
Fe: [Ar]3d64s2 → 2e lớp ngoài cùng.
P: [Ne]3s23p3→ 5e lớp ngoài cùng.
Al: [Ne]3s23p1→ 3e lớp ngoài cùng.
Nguyên tố có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là P.
Câu 24. D
Nguyên tử có 1,2, 3 electron lớp ngoài cùng là nguyên tử của nguyên tố kim loại.
Ta có cấu hình e: 1s22s22p63s2 → 2 e lớp ngoài cùng.
Câu 25. C
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron.
X và Z cùng số proton.
Câu 26. D
Câu 27. B
Ion có số electron > số proton → mang điện tích âm.
Số đơn vị điện tích âm là 18 – 16 = 2.
Vậy ion mang điện tích 2-.
Câu 28. D
Câu 29. B
Sự khác nhau về số nơtron tạo ra các đồng vị của cùng một nguyên tố.
Câu 30. B.
Các electron chuyển động xung quanh hạt nhân với vận tốc lớn và không theo quỹ đạo xác định.