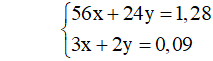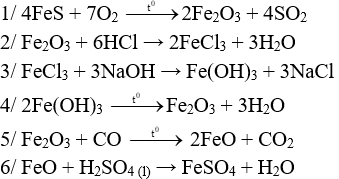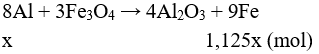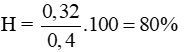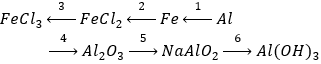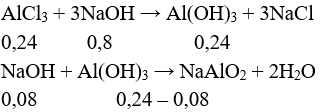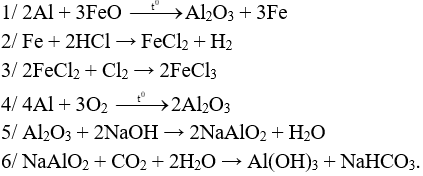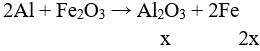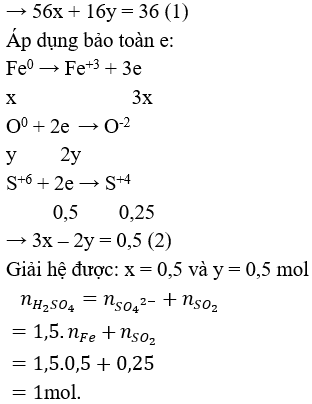Đề thi Giữa kì 2 Hóa học 12 có đáp án (Trắc nghiệm - Tự luận - 5 đề)
Đề thi Giữa kì 2 Hóa học 12 có đáp án (Trắc nghiệm - Tự luận - 5 đề)
Với Đề thi Giữa kì 2 Hóa học 12 có đáp án (Trắc nghiệm - Tự luận - 5 đề) được tổng hợp chọn lọc từ đề thi môn Hoá học 12 của các trường trên cả nước sẽ giúp học sinh có kế hoạch ôn luyện từ đó đạt điểm cao trong các bài thi Hoá học lớp 12.

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 2
Năm học 2023
Môn: Hoá học lớp 12
Thời gian làm bài: 45 phút
(Đề số 1)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Fe = 56, Al = 27, S = 32.
I. Phần trắc nghiệm
Câu 1: Cho sơ đồ phản ứng sau: chất X + H2SO4 → FeSO4 + SO2 + H2O. Hãy cho biết, chất X có thể là chất nào trong số các chất sau?
A. FeSO3.
B. FeS.
C. Fe.
D. Tất cả đều thoả mãn.
Câu 2: Cấu hình electron của ion Cr3+ là
A. [Ar]3d5.
B. [Ar]3d4.
C. [Ar]3d2.
D. [Ar]3d3.
Câu 3: Thuốc thử duy nhất để nhận biết các dung dịch: FeCl2, FeCl3, CrCl3, CuCl2 là
A. Dung dịch H2SO4 loãng.
B. Quỳ tím.
C. Dung dịch Ba(OH)2 dư.
D. Dung dịch HCl.
Câu 4: Khi đốt Fe với bột lưu huỳnh trong điều kiện không có oxi thu được chất X. Hãy cho biết công thức của X.
A. FeS.
B. FeS2.
C. Fe2S3.
D. Cả hỗn hợp 3 chất.
Câu 5: Cho 5,4 gam bột nhôm vào dung dịch HNO3 loãng 1M, nóng, vừa đủ không thấy có khí thoát ra. Thể tích HNO3 đã dùng là
A. 750 ml.
B. 250 ml.
C. 200 ml.
D. 400 ml.
Câu 6: Crom không tan được trong dung dịch
A. H2SO4 đặc, nguội.
B. HBr đặc, nguội.
C. HCl đặc.
D. HNO3 đặc, nóng.
Câu 7: Ion Al3+ bị khử trong trường hợp nào sau đây?
A. Điện phân Al2O3 nóng chảy.
B. Điện phân dd AlCl3 với điện cực trơ có màng ngăn.
C. Dùng H2 khử Al2O3 ở nhiệt độ cao.
D. Thả Na vào dung dịch Al2(SO4)3.
Câu 8: Hoà tan 5,6 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
A. 20.
B. 80.
C. 60.
D. 40.
Câu 9: Phản ứng nào sau đây không đúng?
A. 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O.
B. Fe3O4 + 4H2SO4 → Fe2(SO4)3 + 4H2O.
C. 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O.
D. 6FeCl2 + 3Br2 → 2FeBr3 + 4FeCl3.
Câu 10: Hoà tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml axit H2SO4 0,1M (vừa đủ). Sau phản ứng, hỗn hợp muối sunfat khan thu được khi cô cạn dung dịch có khối lượng là
A. 5,81 gam.
B. 6,81 gam.
C. 4,81 gam.
D. 3,81 gam.
II. Phần tự luận
Câu 1 (3 điểm): Viết các PTHH xảy ra trong sơ đồ sau:
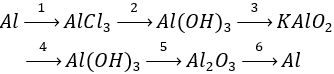
Câu 2 (2 điểm): Cho 42,4 gam hỗn hợp gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3 : 1) tác dụng với dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn. Viết các PTHH xảy ra và Tính giá trị của m.
Câu 3 (2 điểm): Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được 7,8 gam kết tủa. Tính giá trị lớn nhất của V để thu được lượng kết tủa trên.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | A | D | C | A | A | A | A | D | B | B |
Câu 1: FeSO3 + H2SO4 → FeSO4 + SO2 + H2O. Chọn đáp án A.
Câu 2: Cấu hình electron của ion Cr3+ là [Ar]3d3. Chọn đáp án D.
vCâu 3: Dùng Ba(OH)2 dư, hiện tượng:
+ Kết tủa trắng hơi xanh bị hóa nâu đỏ trong không khí → FeCl2
+ Kết tủa nâu đỏ → FeCl3
+ Kết tủa xanh → CuCl2
+ Tạo kết tủa sau đó kết tủa tan trong Ba(OH)2 dư → CrCl3. Chọn đáp án C.
Câu 4: 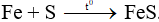
Câu 5:
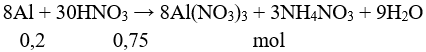
→ V = 0,75 : 1 = 0,75 lít = 750 ml. Chọn đáp án A.
Câu 6: Crom không tan được trong dung dịch H2SO4 đặc, nguội. Chọn đáp án A.
Câu 7: Ion Al3+ bị khử trong trường hợp điện phân Al2O3 nóng chảy. Chọn đáp án A.
Câu 8: Bảo toàn e có nKMnO4 = 0,1 : 5 = 0,02 mol → V = 0,02 : 0,5 = 0,04 lít = 40 ml.
Chọn đáp án D.
Câu 9: Phản ứng không đúng: Fe3O4 + 4H2SO4 → Fe2(SO4)3 + 4H2O. Chọn đáp án B.
Câu 10: nO (oxit) = naxit = ngốc axit = 0,05 mol
mkl (oxit) = 2,81 – 0,05.16 = 2,01 gam.
mmuối = mkl (oxit) + mgốc axit = 2,01 + 0,05.96 = 6,81 gam. Chọn đáp án B.
2. Phần tự luận
Câu 1 (3 điểm): HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT
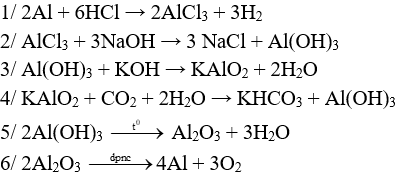
Câu 2 (2 điểm): Gọi số mol Fe3O4 là a → số mol Cu là 3a (mol)
→ 232a + 64.3a = 42,4 → a = 0,1 mol
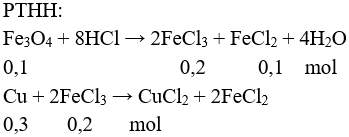
nCu dư = 0,3 – 0,1 = 0,2 → mCu = 0,2.64 = 12,8 gam
Câu 3 (2 điểm): Tính được n↓ = 0,1 mol
Để V là lớn nhất thì sau khi tạo kết tủa, kết tủa tan một phần.
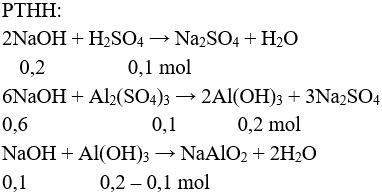
→ nNaOH = 0,2 + 0,6 + 0,1 = 0,9 mol
V = 0,9 : 2 = 0,45 lít.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 2
Năm học 2023
Môn: Hoá học lớp 12
Thời gian làm bài: 45 phút
(Đề số 2)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Al = 27, Fe = 56, Cr = 52.
I. Phần trắc nghiệm
Câu 1: Tìm câu phát biểu đúng?
A. Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) vừa có tính khử và tính oxi hoá.
B. Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) chỉ có tính oxi hoá .
C. Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) chỉ có tính khử.
D. Fe chỉ có tính oxi hoá, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) chỉ có tính khử.
Câu 2: Nhận định nào sau đây sai về Al?
A. Al có tính khử mạnh nhưng yếu hơn Na và Mg.
B. Al thuộc chu kì 3, nhóm IIIA, ô số 13 trong bảng tuần hoàn.
C. Al dẫn điện, dẫn nhiệt tốt, tốt hơn các kim loại Ag và Cu.
D. Al dễ nhường 3 electron hoá trị nên thường có số oxi hoá +3 trong các hợp chất.
Câu 3: Khi cho nhôm tác dụng với dung dịch HNO3 loãng chỉ tạo ra sản phẩm khử là NH4NO3. Tổng các hệ số là số nguyên tối giản nhất trong phương trình hoá học của phản ứng xảy ra là
A. 74.
B. 58.
C. 76.
D. 68.
Câu 4: Khi cho bột sắt dư vào ddAgNO3, hãy cho biết có những phản ứng nào sau đây xảy ra?
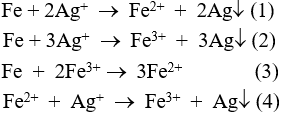
A. Đáp án khác.
B. (1).
C. (1) (4) và (3).
D. (2) và (3).
Câu 5: Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: Mg2+/Mg; Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag. Dãy chỉ gồm các chất, ion tác dụng được với ion Fe3+ trong dung dịch là
A. Fe, Cu, Ag+.
B. Mg, Fe2+, Ag.
C. Mg, Cu, Cu2+.
D. Mg, Fe, Cu.
Câu 6: Tính chất vật lí nào sau đây không phải là tính chất vật lí của sắt?
A. Có tính nhiễm từ.
B. Màu trắng xám, dẻo, dễ rèn.
C. Dẫn điện và dẫn nhiệt tốt.
D. Kim loại nặng, khó nóng chảy.
Câu 7: Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hoà tan tối đa m gam Cu. Giá trị của m là
A. 0,64.
B. 3,20.
C. 1,92.
D. 3,84.
Câu 8: Cho 9g hợp kim Al tác dụng với dung dịch NaOH đặc, nóng, dư thu được 10,08 lít H2 (đktc). % Al trong hợp kim là
A. 90%.
B. 9%.
C. 7,3%.
D. 73%.
Câu 9: Dãy chất nào sau đây phản ứng với cả 2 dung dịch HCl và KOH?
A. Cr2O3, ZnO, Cr(OH)3.
B. ZnO, CrO3, Cr(OH)2.
C. ZnO, CrO3, Cr(OH)3.
D. ZnO, Cr2O3, Cr(OH)2.
Câu 10: Khối lượng K2Cr2O7 tác dụng vừa đủ với 0,6 mol FeSO4 trong môi trường H2SO4 loãng là
vA. 28,4 gam.
B. 29,4 gam.
C. 27,4 gam.
D. 26,4 gam.
II. Phần tự luận
Câu 1 (3 điểm): Viết các PTHH xảy ra trong các trường hợp sau:
a/ Al tác dụng với HCl
b/ Al2O3 tác dụng với KOH
c/ Fe tác dụng với lưu huỳnh
d/ FeO tác dụng với HNO3 loãng
e/ Nhúng dây đồng vào dd FeCl3
f/ Cr tác dụng với HCl nóng
Câu 2 (2 điểm): Cho một lượng hỗn hợp Al, Fe tác dụng với dung dịch H2SO4 loãng, dư thấy thu được 8,96 lít khí ở đktc. Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít khí H2 ở đktc. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Câu 3 (2 điểm): Nung m gam Fe trong bình kín chứa V lít không khí (ở đktc; %V của N2 = 80% còn lại là O2) đến khi oxi phản ứng hết thu được 14,08 gam chất rắn X gồm: Fe và 3 oxit của Fe. Hòa tan toàn bộ X bằng một lượng vừa đủ 42 gam dung dịch H2SO4 98% thu được dung dịch Y (sản phẩm khử duy nhất của S+6 là S+4).
a/ Xác định m, V.
b/ Cho 150 ml H2SO4 1M vào Y thu được dung dịch Z. Z hòa tan tối đa a gam Fe. Xác định a.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | A | C | B | B | D | D | C | A | A | B |
Câu 1: Phát biểu đúng : Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) vừa có tính khử và tính oxi hoá. Chọn đáp án A.
Câu 2: Nhận định sai về Al: Al dẫn điện, dẫn nhiệt tốt, tốt hơn các kim loại Ag và Cu.Chọn đáp án C.
Câu 3: 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Tổng các hệ số là số nguyên tối giản nhất trong phương trình hoá học là 58. Chọn đáp án B.
Câu 4: Khi cho bột sắt dư vào ddAgNO3, phản ứng xảy ra: 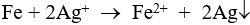
Câu 5: Mg, Fe, Cu tác dụng được với ion Fe3+ trong dung dịch. Chọn đáp án D.
Câu 6: Tính chất vật lí không phải là tính chất vật lí của sắt: “Kim loại nặng, khó nóng chảy”. Chọn đáp án D.
Câu 7:

→ mCu bị hòa tan là 0,03 x 64 = 1,92 g. Chọn đáp án C.
Câu 8: Bảo toàn e có nAl = 0,3 mol → mAl = 0,3.27 = 8,1g.
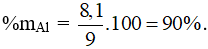
Câu 9: Cr2O3, ZnO, Cr(OH)3 phản ứng với cả 2 dung dịch HCl và KOH. Chọn đáp án A.
Câu 10: Bảo toàn e tính được nK2Cr2O7 = 0,1 mol → m = 0,1. 294 = 29,4 gam. Chọn đáp án B.
2. Phần tự luận
Câu 1 (3 điểm): HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT.
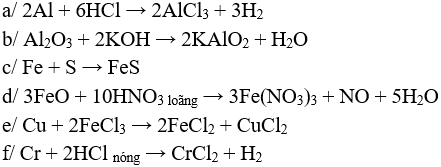
Câu 2 (2 điểm): Gọi số mol Al và Fe trong hỗn hợp lần lượt là x và y (mol)
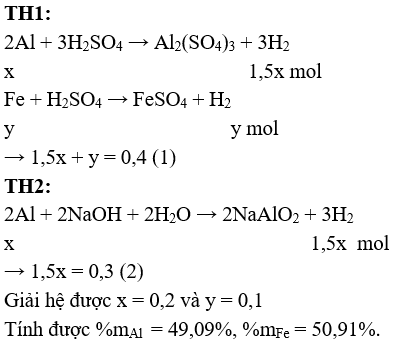
Câu 3 (2 điểm): a/ Qui đổi hỗn hợp X thành: Fe và O2 với số mol lần lượt là x và y mol
Ta có các quá trình:
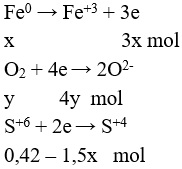
Tính số mol H2SO4 = 0,42 mol
Áp dụng định luật bảo toàn e được:
3x = 4y + 2.(0,42 - 1,5x) (I)
Theo bài ra ta có: 56x + 32y = 14,08 (II)
Giải hệ: x = 0,2; y = 0,09
Vậy m = 0,2.56= 11,2 gam; V = 0,09.5.22,4 = 10,08 lít
b/ Z gồm: H2SO4 0,15 mol và Fe2(SO4)3 0,1 mol
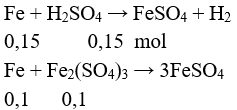
Tính được a = 0,25.56 = 14 gam.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 2
Năm học 2023
Môn: Hoá học lớp 12
Thời gian làm bài: 45 phút
(Đề số 3)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Fe = 56, Cr = 52, Mg = 24, Al = 27.
I. Phần trắc nghiệm
Câu 1: Hỗn hợp X gồm Al, Fe2O3, Cu có số mol bằng nhau. Hỗn hợp X tan hoàn toàn trong
A. AgNO3 dư.
B. NH3 dư.
C. NaOH dư.
D. HCl dư.
Câu 2: Chọn câu đúng ?
A. Khi thêm dung dịch bazơ vào muối cromat màu vàng sẽ tạo thành đicromat có màu da cam.
B. Khi thêm dung dịch axit vào muối cromat màu vàng sẽ tạo thành đicromat có màu da cam.
C. Khi thêm dung dịch axit vào muối cromat màu da cam sẽ tạo thành đicromat có màu vàng.
D. Khi thêm dung dịch bazơ vào muối cromat màu da cam sẽ tạo thành đicromat có màu vàng.
Câu 3: Cation M3+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. Vị trí M trong bảng tuần hoàn là
A. ô 13, chu kì 3, nhóm IIIA.
B. ô 13, chu kì 3, nhóm IIIB.
C. ô 13, chu kì 3, nhóm IA.
D. ô 13, chu kì 3, nhóm IB.
Câu 4: Có các kim loại Cu, Ag, Fe và các dung dịch muối Cu(NO3)2, Fe(NO3)3, AgNO3 . Kim loại nào tác dụng được với cả 3 dung dịch muối?
A. Cu.
B. Ag .
C. Fe.
D. Cu, Fe.
Câu 5: Chọn câu không đúng
A. Nhôm là kim loại nhẹ, dẫn điện, dẫn nhiệt tốt.
B. Nhôm có tính khử mạnh chỉ sau kim loại kiềm và kiềm thổ.
C. Nhôm bị phá hủy trong môi trường kiềm.
D. Nhôm là kim loại lưỡng tính.
Câu 6: Quặng nhôm (nguyên liệu chính) được dùng trong sản xuất nhôm là
A. Boxit Al2O3.2H2O.
B. Criolit Na3AlF6 (hay 3NaF.AlF3).
C. Aluminosilicat (Kaolin) Al2O3.2SiO2.2H2O.
D. Mica K2O.Al2O3.6SiO2.2H2O.
Câu 7: Cần bao nhiêu tấn quặng manhetit chứa 80% Fe3O4 để có thể luyện được 800 tấn gang có hàm lượng 95%. Lượng Fe hao hụt trong sản xuất là 1%.
A. 2351,16 tấn.
B. 3512,61 tấn.
C. 1325,16 tấn.
D. 5213,61 tấn.
Câu 8: Cho 5,2 gam Cr tác dụng với HNO3 loãng dư, thu được V lít khí NO (sản phẩm khử duy nhất ở đktc). V có giá trị là
A. 3,36.
B. 6,72.
C. 4,48.
D. 2,24.
Câu 9: Hoà tan hoàn toàn 1,28 gam hỗn hợp Fe và Mg trong lượng dư dung dịch HNO3 thấy thoát ra 0,03 mol khí NO duy nhất (đktc). Số mol Fe và Mg trong hỗn hợp lần lượt là
A. 0,01 mol và 0,03 mol.
B. 0,02 mol và 0,03 mol.
C. 0,03 mol và 0,02 mol.
D. 0,03 mol và 0,03 mol.
Câu 10: Đốt Fe trong khí clo thiếu thu được hỗn hợp gồm 2 chất rắn. Hãy cho biết thành phần của chất rắn đó:

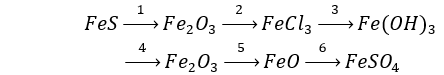
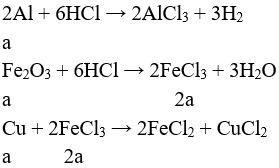
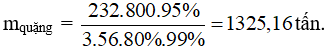 Chọn đáp án C.
Chọn đáp án C.