200 Đề thi Hóa học 12 năm 2024 (có đáp án)
Haylamdo biên soạn và sưu tầm bộ 200 Đề thi Hóa học 12 năm 2024 mới nhất đầy đủ Học kì 1 và Học kì 2 gồm đề thi giữa kì, đề thi học kì có đáp án chi tiết, cực sát đề thi chính thức giúp học sinh ôn luyện & đạt điểm cao trong các bài thi Hóa học 12.
Đề thi Hóa học 12 năm 2024 (có đáp án)
Đề thi Hóa học 12 Kết nối tri thức
Đề thi Hóa học 12 Chân trời sáng tạo
Đề thi Hóa học 12 Cánh diều
Đề cương ôn tập Hóa học 12
Đề cương Hóa học 12 Kết nối tri thức
Đề cương Hóa học 12 Chân trời sáng tạo
Đề cương Hóa học 12 Cánh diều
Lưu trữ: Đề thi Hóa học 12 (sách cũ)
Xem thử Đề Hóa 12 CK1 Xem thử Đề Hóa 12 GK2
Chỉ từ 150k mua trọn bộ Đề thi Hóa học 12 Học kì 1 bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
- [2021] Đề thi khảo sát chất lượng đầu năm Hóa học lớp 12 (10 đề)
- Bộ 20 Đề thi Hóa Học lớp 12 Giữa học kì 1 năm 2024 tải nhiều nhất
- Đề thi Hóa Học lớp 12 Giữa học kì 1 năm 2024 có ma trận (15 đề)
- Đề thi Giữa kì 1 Hóa học 12 có đáp án (4 đề)
- Đề thi Giữa kì 1 Hóa học 12 có đáp án (4 đề)
- Đề thi Hóa học lớp 12 Học kì 1 có đáp án (4 đề)
- Đề thi Giữa kì 2 Hóa học 12 có đáp án (Trắc nghiệm - 4 đề)
- Đề thi Giữa kì 2 Hóa học 12 có đáp án (Trắc nghiệm - Tự luận - 5 đề)
- Đề thi Giữa kì 2 Hóa học 12 có đáp án (Trắc nghiệm - 4 đề)
- Đề thi Giữa kì 2 Hóa học 12 có đáp án (Trắc nghiệm - Tự luận - 5 đề)
- Đề thi Học kì 2 Hóa học lớp 12 có đáp án (4 đề)
- Đề thi Hóa học 12 Học kì 2 có đáp án (5 đề)
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 1
Năm học 2024 - 2025
Môn: Hóa học 12
Thời gian làm bài: phút
(Đề thi số 1)
Họ và tên thí sinh: ....................................................
Số báo danh : ........................
Cho nguyên tử khối cuả một số nguyên tố: H =1; C =12; N =14; O =16; Na =23; K = 39; Ca = 40; Ba = 137; Ag =108.
Câu 1. Phản ứng giữa cặp chất nào sau đây tạo ra etyl axetat?
A. Axit fomic và ancol etylic.
B.Axit fomic và ancol metylic.
C. Axit axetic và ancol metylic.
D. Axit axetic và ancol etylic.
Câu 2. Este Metyl fomat có công thức là
A. HCOOC2H5. B. CH3COOCH3.
C. HCOOCH3. D. HCOOCH=CH2.
Câu 3. Khẳng định nào sau đây không đúng:
A. Chất béo là đieste của glixerol với axit béo.
B. Thủy phân chất béo trong KOH thì thu được xà phòng.
C. Thủy phân chất béo thu được glixerol
D. Chất béo là một loại Lipit.
Câu 4. Để khử mùi tanh của cá (gây ra do một số amin, nhiều nhất là trimetylamin), ta có thể rửa cá với:
A. nước muối B. nước C. giấm D. cồn
Câu 5. Cho các chất X, Y, Z, T thỏa mãn bảng sau :
Chất Thuốc thử |
X |
Y |
Z |
T |
NaOH |
Có phản ứng |
Có phản ứng |
Không phản ứng |
Có phản ứng |
NaHCO3 |
Sủi bọt khí |
Không phản ứng |
Không phản ứng |
Không phản ứng |
Cu(OH)2 |
hòa tan |
Không phản ứng |
Hòa tan |
Không phản ứng |
AgNO3/NH3 |
Không tráng gương |
Có tráng gương |
Tráng gương |
Không phản ứng |
X, Y, Z, T lần lượt là
A. CH3COOH, CH3COOCH3, glucozơ, CH3CHO.
B. HCOOH, CH3COOH, glucozơ, phenol.
C. CH3COOH, HCOOCH3 , glucozơ, phenol.
D. HCOOH, HCOOCH3, fructozơ, phenol.
Câu 6. Trong công nghiệp để tráng bạc vào ruột phích, người ta thường sử dụng phản ứng hoá học nào sau đây?
A. Cho axetilen tác dụng với dung dịch AgNO3/NH3.
B. Cho anđehit fomic tác dụng với dung dịch AgNO3/NH3.
C. Cho glucozơ tác dụng với dung dịch AgNO3/NH3.
D. Cho axit fomic tác dụng với dung dịch AgNO3/NH3.
Câu 7. Cho các phản ứng : H2N - CH2 - COOH + HCl 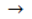 Cl-H3N+ - CH2 - COOH.
Cl-H3N+ - CH2 - COOH.
H2N - CH2 - COOH + NaOH 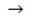 H2N - CH2 - COONa + H2O.
H2N - CH2 - COONa + H2O.
Hai phản ứng trên chứng tỏ axit aminoaxetic.
A. chỉ có tính bazơ B. có tính oxi hóa và tính khử
C. chỉ có tính axit D. có tính chất lưỡng tính
Câu 8. Số đồng phân este ứng với công thức phân tử C3H6O2 là
A. 2. B. 4. C. 3. D. 1.
Câu 9. Đun 6 gam axit axetic với 6,9 gam etanol (có H2SO4 đặc làm xúc tác) đến khi phản ứng đạt tới trạng thái cân bằng, thu được 6,6 gam este. Hiệu suất của phản ứng este hoá là:
A. 62,5%. B. 55%. C. 75%. D. 50%.
Câu 10. Đốt cháy hoàn toàn một amin đơn chức, no mạch hở, bậc 2 thu được CO2 và H2O với tỷ lệ mol tương ứng là 4 : 7. Tên gọi của amin đó là
A. etylamin. B. đietylamin. C. iso-propylamin. D. đimetylamin.
Câu 11. Đốt cháy hoàn toàn 11,1 (g) este đơn chức A, thu được 10,08 lít(đktc) CO2 và 8,1 (g) nước.
Mặt khác, cho 11,1 gam A tác dụng hoàn toàn với 250 ml dd NaOH 1M và đem cô cạn dung dịch sau phản ứng thu được 14,2 gam chất rắn khan. Este A là:
A. CH3COOCH3 B. HCOOCH3 C. CH3COOC2H5 D. HCOOCH2CH3
Câu 12. Thuốc thử cần dùng để nhận biết hồ tinh bột, glucozơ, saccarozơ là
A. Cu(OH)2. B. Iot, dung dịch AgNO3/NH3.
C. C. nước, Iot. D. dung dịch AgNO3/NH3, Cu.
Câu 13. Có thể gọi tên este (C17H33COO)3C3H5 là
A. triolein B. tristearin
C. stearic D. tripanmitin
Câu 14. Cho 27 gam glucozo thực hiện phản ứng tráng gương. Sau khi phản ứng kết thúc thu được m gam Ag. Giá trị của m là:
A. 21,6. B. 10,8 C. 5,4 D. 32,4
Câu 15. X,Y,Z là 3 este đều đơn chức, mạch hở ( trong đó Y và Z không no chứa một liên kết C=C và có tồn tại đồng phân hình học). Đốt cháy 21,62 gam hỗn hợp E chứa X,Y,Z với oxi vừa đủ, sản phẩm cháy dẫn qua dung dịch Ca(OH)2 dư thấy khối lượng dung dịch giảm 34,5 gam so với trước phản ứng. Mặt khác, đun nóng 21,62 gam E với 300ml dung dịch NaOH 1M ( vừa đủ), thu được hỗn hợp F chỉ chứa 2 muối và hỗn hợp gồm 2 ancol kế tiếp thuộc cùng dãy đồng đẳng. Khối lượng của muối có khối lượng phân tử lớn hơn trong hỗn hợp F là
A. 8,64 gam. B. 4,68 gam. C. 8,1 gam. D. 9,72 gam.
Câu 16. Thủy phân este X trong môi trường kiềm, thu được natri axetat và ancol metylic. Công thức của X là
A. CH3COOCH3. B. C2H5COOCH3. C. CH3COOC2H5. D. C2H3COOC2H5.
Câu 17. Cho 2,0 gam hỗn hợp X gồm metylamin, đimetylamin phản ứng vừa đủ với 0,05 mol HCl, thu được m gam muối. Giá trị của m là :
A. 2,550. B. 4,725. C. 3,825. D. 3,425.
Câu 18. Đun nóng hỗn hợp gồm 0,1 mol C6H5OOC-CH2-COOCH3 và 0,15 mol axit CH3COOH với 600 ml dd NaOH 1M đến phản ứng hoàn toàn. Cô cạn dung dịch sau phản ứng thì thu được m gam chất rắn khan. Giá trị của m là
A.42,8 gam B.46,5 gam C. 44,7 gam D.40,5 gam
Câu 19. Đốt cháy hoàn toàn m gam 1 chất béo triglixerit cần 1,61 mol O2, sinh ra 1,14 mol CO2 và 1,06 mol H2O. Cho 7,088 gam chất béo tác dụng vừa đủ với dung dịch NaOH thì khối lượng muối tạo thành là:
A. 7,412 gam B. 7,612 gam C. 7,312 gam D. 7,512 gam
Câu 20. Dầu mỡ động, thực vật để lâu thường có mùi khó chịu, ta gọi đó là hiện tượng
A. đông tụ. B. mỡ bị ôi. C. thủy phân. D. oxi hóa.
Câu 21. Cho m gam glucozo lên men thành rượu etylic và tất cả khí CO2 thoát ra hấp thụ vào dung dịch NaOH dư thì thu được dung dịch chứa 3,18g Na2CO3. Các phản ứng xảy ra hoàn toàn, giá trị của m là
A. 2,7 B. 1,8 C. 5,4 D. 3,6
Câu 22. Số đồng phân amin bậc 1 của công thức C4H11N là:
A. 2 B. 8 C. 3 D. 4
Câu 23. Dung dịch đường nào sau đây dùng để tiêm hoặc truyền vào tĩnh mạch của bệnh nhân?
A. Glucozơ B. Fructozơ
C. Saccarozơ D. Đường lấy từ hoa thốt nốt.
Câu 24. Chất nào sau đây đổi màu quỳ tím sang xanh?
A. glyxin B. alanin
C. etylamin D. anilin
Câu 25. Cho các chất: (1) amoniac, (2) metylamin, (3) anilin.
Tính bazơ tăng dần theo thứ tự nào sau đây?
A. (3) < (1) < (2). B. (1) < (3) < (2) .
C. (1) < (2) < (3) . D. (3) < (2) < (1).
Câu 26. Glyxin không tác dụng với chất:
A. Ca(OH)2 B. KCl C. H2SO4 loãng D. CH3OH
Câu 27. X là một aminoaxit có trong tự nhiên. Cho 0,01 mol X tác dụng vừa đủ với 0,01 mol HCl tạo muối Y. Lượng Y sinh ra tác dụng vừa đủ với 0,02 mol NaOH tạo 1,11 gam muối hữu cơ Z. X là
A. HOOC - CH2 - CH2 - COOH B. CH3 - CH(NH2) - COOH
C. H2N - CH2 - COOH D. HOOC - CH(NH2) - COOH
Câu 28. Dãy các chất đều có khả năng tham gia phản ứng thủy phân trong dung dịch H2SO4 loãng, đun nóng là:
A. saccarozơ, tinh bột và xenlulozơ. B. fructozơ, saccarozơ và tinh bột.
C. glucozơ, saccarozơ và fructozơ. D. glucozơ, tinh bột và xenlulozơ.
Câu 29. Đốt cháy hoàn toàn m gam một hỗn hợp X (glucozơ, fructozơ, saccarozơ và metyl fomat, axit axetic) cần 4,48 lít O2 (điều kiện chuẩn), sinh ra 3,42 gam nước. Giá trị của m là
A. 5,82 B. 6,14 C. 4,86 D. 2,98
Câu 30. Amino axit là hợp chất hữu cơ trong phân tử
A. chứa nhóm hiđroxyl và nhóm amino. B. chỉ chứa nhóm amino.
C. chứa nhóm cacboxyl và nhóm amino. D. chỉ chứa nhóm cacboxyl.
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2024 - 2025
Môn: Hóa học 12
Thời gian làm bài: phút
(Đề thi số 1)
Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Cl = 35,5; Al = 27; K = 39; Ca = 40; Ag = 108, Ba = 137, Mg = 24, Cu = 64, Fe = 56, Mn = 55.
Câu 1: Kim loại nào sau đây tác dụng được với nước ở nhiệt độ thường?
A. Fe. B. Cu.
C. Na. D. Ag.
Câu 2: Kim loại có nhiệt độ nóng chảy cao nhất là
A. Hg. B. Ag.
C. W. D. Fe.
Câu 3: Chất nào sau đây thuộc loại chất béo?
A. Natri oleat. B. Tristearin.
C. Etyl axetat. D. Metyl fomat.
Câu 4: Polietilen (PE) được sử dụng làm chất dẻo. PE được tạo ra bằng phản ứng trùng hợp chất nào sau đây
A. CH2=CH-CI. B. CH2=CH-CN.
C. CH2=CH-CH3. D. CH2=CH2.
Câu 5: Anilin có công thức là
A. C6H5-NH2. B. CH3NH2.
C. NH2-CH2-COOH. D. NH2-CH(CH3)-COOH.
Câu 6: Công thức phân tử của etyl fomat là
A. C4H8O2. B. C3H4O2.
C. C2H4O2. D. C3H6O2.
Câu 7: Phương trình hóa học nào sau đây sai?
A. Cu + FeSO4 → Fe + CuSO4.
B. Mg + Cl2 → MgCl2.
C. Mg + CuSO4 → Cu + MgSO4.
D. 2Al + 3Cl2 → 2AlCl3.
Câu 8: Hợp chất nào dưới đây thuộc loại amino axit ?
A. C2H5NH2. B. CH3COOC2H5.
C. NH2CH2COOH. D. HCOONH4.
Câu 9: Trong các ion sau đây, ion nào có tính oxi hóa mạnh nhất?
A. Ca2+. B. Zn2+.
C. Ag+. D. Cu2+.
Câu 10: Kim loại nào sau đây không tan trong dung dịch HCl?
A. Al. B. Cu.
C. Zn. D. Mg.
Câu 11: Glucozơ thuộc loại monosaccarit, nó được dùng làm thuốc tăng lực cho người già, trẻ em và người ốm. Glucozơ có công thức là
A. C12H22O11. B. (C6H10O5)n.
C. C6H14O6. D. C6H12O6.
Câu 12: Cho các kim loại sau: Na, K, Fe, Mg. Kim loại có tính khử mạnh nhất là?
A. Na. B. Mg.
C. K. D. Fe.
Câu 13: Trong thành phần chất nào sau đây có nguyên tố nitơ?
A. Metylamin. B. Glucozơ.
C. Etyl axetat. D. Tinh bột.
Câu 14: Cho m gam Fe tác dụng hoàn toàn với lượng dư dung dịch HCl thu được 2,24 lít khí H2 (đktc). Giá trị của m là
A. 5,6. B. 2,8.
C. 8,4. D. 11,2.
Câu 15: Thủy phân este nào sau đây (trong dung dịch NaOH vừa đủ) thu được natri axetat và ancol?
A. HCOOCH3. B. HCOOC2H5.
C. C2H3COOCH3. D. CH3COOCH3.
Câu 16: Polime nào sau đây thuộc loại polime thiên nhiên?
A. Polistiren. B. Polietilen.
C. Polipropilen. D. Tinh bột.
Câu 17: Cho y gam kim loại M vào dung dịch Fe2(SO4)3 dư, sau phản ứng hoàn toàn khối lượng phần dung dịch tăng thêm y gam. Kim loại M là
A. Ba. B. Cu.
C. K. D. Ag.
Câu 18: Phát biểu nào sau đây đúng?
A. PVC được điều chế bằng phản ứng trùng hợp.
B. Tơ visco thuộc loại tơ tổng hợp.
C. Amilozơ có cấu trúc mạch phân nhánh.
D. Tơ tằm thuộc loại tơ nhân tạo.
Câu 19:Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may làm vỡ nhiệt kế thủy ngân thì dùng chất nào sau đây để khử độc thủy ngân?
A. Bột lưu huỳnh. B. Bột than.
C. Nước. D. Bột sắt.
Câu 20: Cho phản ứng: aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O. Các hệ số a, b, c, d, e là những số nguyên, tối giản. Tổng (a + b) bằng
A. 5. B. 4.
C. 8. D. 6.
Câu 21: Phân tử khối của peptit Ala-Ala-Ala là
A. 249. B. 189.
C. 267. D. 231.
Câu 22: Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu xanh?
A. Glyxin. B. Axit glutamic.
C. Etylamin. D. Alanin.
Câu 23: Thực hiện phản ứng tráng bạc hoàn toàn dung dịch chứa 18,0 gam glucozơ, thu được tối đa m gam Ag. Giá trị của m là
A. 10,8. B. 5,4.
C. 32,4. D. 21,6.
Câu 24: Thí nghiệm nào sau đây thu được muối sắt (III) sau khi phản ứng kết thúc?
A. Cho FeO vào dung dịch H2SO4 loãng, dư.
B. Cho Fe vào dung dịch HNO3 loãng, dư.
C. Cho Fe vào dung dịch HCl dư.
D. Cho Fe(OH)2 vào dung dịch HCl.
Câu 25: Xà phòng hóa hoàn toàn 0,1 mol chất béo X thu được glixerol và hỗn hợp muối gồm 30,6 gam C17H35COONa và 60,8 gam C17H33COONa. Cho 17,72 gam X tác dụng với lượng dư dung dịch nước brom, số mol brom tối đa phản ứng là
A. 0,02. B. 0,20.
C. 0,40. D. 0,04.
Câu 26: Có 2 kim loại X, Y thỏa mãn các tính chất sau:
| Dung dịch | Kim loại | |
|---|---|---|
| X | Y | |
| HCl | Tác dụng | Không tác dụng |
| HNO3 đặc, nguội | Tác dụng | Tác dụng |
Kim loại X, Y lần lượt là
A. Mg, Cu. B. Cu, Mg.
C. Fe, Mg. D. Al, Fe.
Câu 27: Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Cu và FeS vào dung dịch chứa 0,32 mol H2SO4 (đặc), đun nóng, thu được dung dịch Y (chất tan chỉ gồm các muối trung hòa) và 0,24 mol SO2 (là chất khí duy nhất). Cho 0,25 mol NaOH phản ứng hết với dung dịch Y, thu được 7,63 gam kết tủa. Giá trị của m là
A. 5,61. B. 4,66.
C. 5,44. D. 5,34.
Câu 28: Lên men m gam tinh bột để sản xuất ancol etylic (hiệu suất cả quá trình là 80%). Toàn bộ lượng CO2 sinh ra hấp thụ hoàn toàn vào dung dịch nước vôi trong dư thu được 40,0 gam kết tủa. Giá trị của m là
A. 40,50. B. 25,92.
C. 45,00. D. 28,80.
Câu 29: Thủy phân hoàn toàn m gam este đơn chức X trong dung dịch NaOH vừa đủ. Sau phản ứng thu được 8,2 gam muối và 4,6 gam ancol etylic. Giá trị của m là
A. 12,80. B. 8,80.
C. 7,40. D. 7,20.
Câu 30: Cho các phát biểu sau:
(a) Trong công nghiệp, saccarozơ được chuyển hóa thành glucozơ dùng để tráng gương, tráng ruột phích.
(b) Phân tử Val-Ala có 8 nguyên tử cacbon.
(c) Saccarozơ tham gia phản ứng thủy phân trong môi trường kiềm.
(d) Dung dịch anbumin phản ứng với Cu(OH)2 trong môi trường kiềm.
(e) Xenlulozơ là thành phần chính tạo nên lớp màng tế bào thực vật, là bộ khung của cây cối.
Số phát biểu đúng là
A. 5. B. 4.
C. 3. D. 2.
Câu 31: Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl2, Cu(NO3)2, AgNO3, NaCl. Số trường hợp có phản ứng hóa học xảy ra là
A. 1. B. 3.
C. 2. D. 4.
Câu 32: Cho 19,5 gam hỗn hợp X gồm glyxin và etylamin tác dụng vừa đủ với 200 ml dung dịch NaOH 1,0M. Mặt khác, nếu cho 19,5 gam X tác dụng vừa đủ với V ml dung dịch HCl 1,0M, thu được m gam muối. Giá trị của V và m lần lượt là
A. 300 và 23,90. B. 200 và 26,80.
C. 200 và 23,15. D. 300 và 30,45.
Câu 33: Nhúng thanh Fe vào dung dịch CuSO4. Sau một thời gian, quan sát thấy hiện tượng gì?
A. Thanh Fe có màu trắng và dung dịch nhạt dần màu xanh.
B. Thanh Fe có màu đỏ và dung dịch nhạt dần màu xanh.
C. Thanh Fe có màu đỏ và dung dịch dần có màu xanh.
D. Thanh Fe có màu trắng xám và dung dịch nhạt dần màu xanh.
Câu 34: Cho vào ống nghiệm 3 - 4 giọt dung dịch CuSO4 5% và 2 ml dung dịch NaOH 10%. Lắc nhẹ, gạn bỏ phần dung dịch, giữ lại kết tủa Cu(OH)2. Tiếp tục nhỏ 2 ml dung dịch chất X nồng độ 1% vào ống nghiệm, lắc nhẹ, thu được dung dịch màu xanh lam. X không thể là
A. glucozơ. B. fructozơ.
C. saccarozơ. D. metanol.
Câu 35: Cho 3,36 gam bột sắt vào 300 ml dung dịch CuSO4 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
A. 0,96. B. 5,76.
C. 3,48. D. 2,52.
Câu 36: Đốt cháy 5,64 gam hỗn hợp gồm Mg, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 25,52 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 12,544 lít. B. 4,928 lít.
C. 6,272 lít. D. 3,136 lít.
Câu 37: Cho 39 gam kim loại Kali vào 362 gam nước thu được dung dịch X. Nồng độ phần trăm của chất tan trong dung dịch X là
A. 10,00%. B. 14,00%.
C. 9,75%. D. 13,96%.
Câu 38: Một α-amino axit X (trong phân tử có một nhóm -NH2 và một nhóm -COOH). Cho 21,36 gam X phản ứng với lượng dư dung dịch NaOH, thu được dung dịch chứa 26,64 gam muối. Công thức của X là
A. H2N-CH(C2H5)-COOH. B. H2N-CH(CH3)-COOH.
C. H2N-CH2-COOH. D. H2N-(CH2)2-COOH.
Câu 39: Thủy phân 14,6 gam Gly-Ala trong dung dịch NaOH dư thu được m gam muối. Giá trị của m là
A. 16,8. B. 20,8.
C. 18,6. D. 20,6.
Câu 40: Đốt cháy hoàn toàn m gam hỗn hợp E gồm hai este mạch hở X và Y (đều tạo bởi axit cacboxylic và ancol, MX < MY < 150) thu được 4,48 lít khí CO2. Cho m gam E tác dụng vừa đủ với dung dịch NaOH, thu được một ancol Z và 6,76 gam hỗn hợp muối. Cho toàn bộ Z tác dụng với Na dư, thu được 1,12 lít khí H2. Phần trăm khối lượng của X trong E là
A. 44,30%. B. 74,50%.
C. 60,40%. D. 50,34%.
Đáp án & Thang điểm
Câu 1: Đáp án C
Na là kim loại kiềm nên tác dụng được với nước ở ngay nhiệt độ thường.
2Na + 2H2O → 2NaOH + H2↑
Câu 2: Đáp án C
W có nhiệt độ nóng chảy cao nhất (3410oC).
Câu 3: Đáp án B
Chất béo là Trieste của glixerol với axit béo.
Câu 4: Đáp án D
PE được tạo ra bằng phản ứng trùng hợp etilen (CH2 = CH2).
Câu 5: Đáp án A
Anilin: C6H5 – NH2.
Câu 6: Đáp án D
Etyl fomat: HCOOC2H5 → CTPT là: C3H6O2.
Câu 7: Đáp án A
Tính khử của Cu < Fe, do đó phản ứng A không xảy ra.
Câu 8: Đáp án C
Amino axit là hợp chất hữu cơ tạp chức, phân tử chứa đồng thời nhóm amino (NH2) và nhóm cacboxyl (COOH).
→ NH2CH2COOH là amino axit.
Câu 9: Đáp án C
Ta có tính oxi hóa: Ca2+ < Zn2+ < Cu2+ < A+.
Câu 10: Đáp án B
Cu đứng sau H trong dãy hoạt động hóa học nên không tác dụng được với HCl.
Câu 11: Đáp án D
Glucozơ: C6H12O6.
Câu 12: Đáp án C
Thứ tự dãy hoạt động hóa học của kim loại: K, Na, Mg, Al ….
Vậy K có tính khử mạnh nhất.
Câu 13: Đáp án A
Metyl amin: CH3NH2.
Câu 14: Đáp án A
Bảo toàn electron có:
2.nFe = 2.nkhí → nFe = nkhí = 0,1 mol.
mFe = 0,1.56 = 5,6 gam.
Câu 15: Đáp án D
CH3COOCH3 + NaOH → CH3COONa + CH3OH.
Câu 16: Đáp án D
Tinh bột là polime thiên nhiên.
Câu 17: Đáp án B
Do thêm kim loại M vào dung dịch Fe2(SO4)3, khối lượng dung dịch tăng đúng bằng khối lượng kim loại phản ứng nên sau phản ứng không thu được kết tủa cũng không có khí thoát ra.
Vậy M là Cu.
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4.
Câu 18: Đáp án A
PVC được điều chế bằng phản ứng trùng hợp vinyl clorua.
B sai vì tơ visco thuộc loại tơ bán tổng hợp.
C sai vì amilozơ có cấu trúc mạch không phân nhánh.
Câu 19:Đáp án A
Thủy ngân phản ứng với lưu huỳnh ở ngay nhiệt độ thường.
Hg + S → HgS.
Câu 20: Đáp án A
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
→ a + b = 1 + 4 = 5.
Câu 21: Đáp án D
MAla – Ala – Ala = 3.89 – 2.18 = 231 (g/mol).
Câu 22: Đáp án C
Etylamin: C2H5NH2 có tính bazơ nên làm quỳ tím chuyển sang màu xanh.
Câu 23: Đáp án D
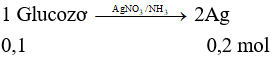
→ m = 0,2.108 = 21,6 gam.
Câu 24: Đáp án B
FeO + H2SO4 loãng → FeSO4 + H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
Fe + 2HCl → FeCl2 + H2
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Vậy cho Fe vào HNO3 loãng, dư thu được muối sắt (III).
Câu 25: Đáp án D
Ta có: C17H35COONa: 0,1 mol; C17H33COONa: 0,2 mol
Vậy X là: (C17H33COO)2C3H5OCOC17H35
(C17H33COO)2C3H5OCOC17H35 + 2Br2 → (C17H33Br2COO)2C3H5OCOC17H35
Xét 17,72 gam X → nX = 0,02 mol → nbrom = 2.nX = 0,04 (mol).
Câu 26: Đáp án A
Mg vừa tác dụng với HCl, vừa tác dụng với HNO3 đặc, nguội.
Cu không tác dụng với HCl nhưng tác dụng với HNO3 đặc, nguội.
Câu 27: Đáp án A
Bảo toàn H có nH2O = naxit = 0,32 mol.
Bảo toàn O có:
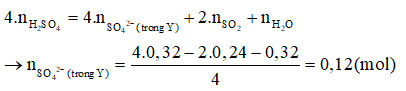
Cho NaOH phản ứng hết với Y, sau phản ứng dung dịch thu được chứa: Na+: 0,25 mol; SO42-: 0,12 mol; AlO2- x mol.
Bảo toàn điện tích → x = 0,25 – 2.0,12 = 0,01 (mol)
nOH-(trong ↓) = nOH- (ban đầu) – 4.nAlO2- = 0,25 – 4.0,01 = 0,21 (mol)
mKL (trong ↓) = m↓ - mOH-(trong ↓) = 7,63 – 0,21.17 = 4,06 gam.
Bảo toàn S có:
nS (trong FeS) + nS (trong axit) = nS (trong khí) + nS (trong SO42- ở Y)
→ nS (trong FeS) = 0,24 + 0,12 – 0,32 = 0,04 mol
→ m = mKL(trong ↓) + mS (trong FeS) + mAl (trong AlO2-) = 4,06 + 0,04.32 + 0,01.27 = 5,61 gam.
Câu 28: Đáp án A
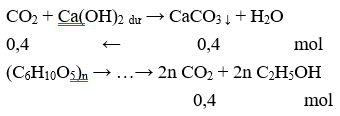
Giả sử H = 100% → ntinh bột = 0,2/n (mol) → mtinh bột = m = 0,2/n .162n = 32,4 gam.
Do H = 80% nên m = 32,4/80% = 40,5 gam.
Câu 29: Đáp án B
Este X có dạng: RCOOC2H5
RCOOC2H5 + NaOH (0,1) → RCOONa + C2H5OH (0,1 mol)
Bảo toàn khối lượng có:
mX + mNaOH = mmuối + mancol → mX = 8,2 + 4,6 – 0,1.40 = 8,8 gam.
Câu 30: Đáp án B
(a) (b) (d) (e) đúng
(c) sai vì Saccarozơ tham gia phản ứng thủy phân trong môi trường axit hoặc xúc tác enzim.
Câu 31: Đáp án C
Fe + FeCl2 → không phản ứng
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + NaCl → không phản ứng.
Câu 32: Đáp án D
Gọi số mol của glyxin và etylamin lần lượt là x và y mol.
Khi cho X vào NaOH chỉ có glyxin phản ứng.
nGly = nNaOH = 0,2 mol
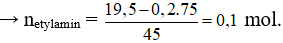
Cho X tác dụng với NaCl thì cả glyxin và etylamin phản ứng:
nHCl = nGlyxin + netylamin = 0,2 + 0,1 = 0,3 mol → VHCl = 0,3/1 = 0,3 lít = 300ml.
Bảo toàn khối lượng có: mmuối = mX + maxit = 19,5 + 0,3.36,5 = 30,45 gam.
Câu 33: Đáp án B
Fe + CuSO4 → FeSO4 + Cu
Hiện tượng: Dung dịch nhạt màu dần, có lớp kim loại màu đỏ bám ngoài đinh sắt.
Câu 34: Đáp án D
Metanol (CH3OH) không phản ứng với Cu(OH)2.
Câu 35: Đáp án C
Fe (0,06) + CuSO4 (0,015 mol) → Cu + FeSO4
Sau phản ứng CuSO4 hết, Fe dư.
m = 3,36 + (64 – 56).0,015 = 3,48 gam.
Câu 36: Đáp án C
Bảo toàn khối lượng có: mkhí = mmuối – mKL = 25,52 – 5,64 = 19,88 gam
→ nkhí = 19,88/71 = 0,28 mol, Vkhí = 0,28.22,4 = 6,272 lít.
Câu 37:

mCt = mKOH = 1.56 = 56 gam.
mdd = mKL + mnước - mkhí = 39 + 362 – 0,5.1 = 400 gam.
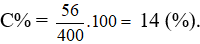
Câu 38: Đáp án B
Đặt X có dạng: H2N – R – COOH.
H2N – R – COOH + NaOH → H2N – R – COONa + H2O
Cứ 1 mol X thu được 1 mol muối → khối lượng tăng 22 gam
→ Khối lượng tăng 26,64 – 21,36 = 5,28 gam → nX = 0,24 mol.
→ MX = 21,36 : 0,24 = 89. Mà X là α-amino axit nên có CTCT là: H2N-CH(CH3)-COOH.
Câu 39: Đáp án B
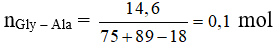
Sau phản ứng thu được 2 muối: H2N-CH2-COONa: 0,1 mol và H2N-CH(CH3)-COONa: 0,1 mol
mmuối = 0,1 (97 + 111) = 20,8 gam.
Câu 40:
nCO2 = 0,2 mol; nH2 = 0,05 mol → n(-OH ancol) = 0,1 mol → nC (trong ancol) ≥ 0,1 mol;
nNaOH = nO (trong Z) = 0,1 → nC (muối) ≥ 0,1 mol.
nC (trong E) = nC (trong ancol) + nC (muối) = nCO2 = 0,2 mol
→ nC (trong ancol) = 0,1 mol; nC (muối) = 0,1 mol.
→ Ancol có số C = số O; muối có số C = số Na. Vậy ancol là CH3OH (0,1 mol); các muối là HCOONa a mol và (COONa)2 b mol
Bảo toàn Na có: a + 2b = nNaOH = 0,1 mol (1).
mmuối = 6,76 gam → 68a + 134b = 6,76 gam (2)
Từ (1) và (2) có a = 0,06 và b = 0,02.
X là HCOOCH3 0,06 mol và Y là (COOCH3)2 0,02 mol.
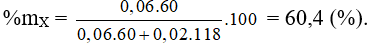
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Năm học 2024 - 2025
Môn: Hóa học 12
Thời gian làm bài: phút
(Đề thi số 1)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Al = 27, Fe = 56.
I. Phần trắc nghiệm
Câu 1: Phản ứng hóa học nào không xảy ra khi thực hiện quá trình luyện gang trong lò cao?
A. C + O2 → CO2.
B. C + 2O2 → 2CO.
C. 2C + O2 → 2CO.
D. Cả A và C.
Câu 2: Phát biểu nào dưới đây là đúng?
A. Nhôm là một kim loại lưỡng tính.
B. Al2O3 là một oxit trung tính.
C. Al(OH)3 là một bazơ lưỡng tính.
D. Al(OH)3 là một hiđroxit lưỡng tính.
Câu 3: Tính chất nào sau đây là tính chất chung của các hợp chất: FeO, Fe2O3, Fe(OH)2, Fe(OH)3?
A. Tính khử.
B. Tính oxi hoá.
C. Tính bazơ
D. Tính axit.
Câu 4: Cho 32,04 gam AlCl3 vào 500 ml dung dịch NaOH 1,6M sau khi phản ứng xong thu được thu được bao nhiêu gam kết tủa?
A. 12,48 gam.
B. 4,68 gam.
C. 18,72gam.
D. 6,24 gam.
Câu 5: Nhôm không tan trong dung dịch nào dưới đây?
A. HCl.
B. H2SO4.
C. KHSO4.
D. NH3.
Câu 6: Quặng manđehit chứa
A. Fe2O2.
B. Fe2O3.nH2O.
C. Fe3O4.
D. FeCO3.
Câu 7: Crom không tan được trong dung dịch
A. H2SO4 đặc, nguội.
B. HBr đặc, nguội.
C. HCl đặc.
D. HNO3 đặc, nóng.
Câu 8: Biết cấu hình của Fe là: 1s22s22p63s23p63d64s2. Vị trí của Fe trong bảng tuần hoàn là
A. Ô: 26, chu kì: 4, nhóm VIIIB.
B. Ô: 25, chu kì: 3, nhóm IIB.
C. Ô: 26, chu kì: 4, nhóm IIA.
D. Ô: 20, chu kì: 3, nhóm VIIIA.
Câu 9: Các số oxi hoá đặc trưng của Crom trong hợp chất là
A. +1, +2, +4, +6.
B. +3, +4, +6.
C. +2, +4, +6.
D. +2, + 3, +6.
Câu 10: Khử hoàn toàn 16g bột oxit sắt nguyên chất bằng CO ở nhiệt độ cao. Sau khi phản ứng kết thúc, khối lượng chất rắn giảm 4,8g. Oxit sắt đã dùng là
A. Fe2O
B. Fe2O3
C. FeO
D. Fe3O4
II. Phần tự luận
Câu 1 (3 điểm): Hoàn thiện các PTHH xảy ra trong sơ đồ sau:
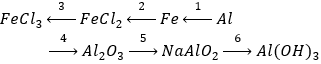
Câu 2 (2 điểm): Cho 1,56 gam hỗn hợp gồm Al và Al2O3 phản ứng hết với dung dịch HCl (dư), thu được V lít khí H2 (đktc) và dung dịch X. Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Viết các PTHH xảy ra và tính giá trị của V.
Câu 3 (2 điểm): Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau:
- Phần 1 tác dụng với dung dịch H2SO4 loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc);
- Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc).
Tính giá trị của m.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | C | D | C | A | D | C | A | A | D | B |
Câu 1: Phản ứng hóa học không xảy ra khi thực hiện quá trình luyện gang trong lò cao:
2C + O2 → 2CO. Chọn đáp án C.
Câu 2: Phát biểu đúng : Al(OH)3 là một hiđroxit lưỡng tính. Chọn đáp án D.
Câu 3: Các hợp chất: FeO, Fe2O3, Fe(OH)2, Fe(OH)3 đều có tính bazơ. Chọn đáp án C.
Câu 4:
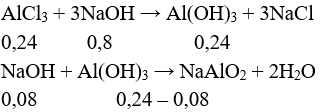
→ n↓ = 0,16 → m↓ = 0,16.78 = 12,48 gam. Chọn đáp án A.
Câu 5: Nhôm không tan trong dung dịch NH3. Chọn đáp án D.
Câu 6: Quặng manđehit chứa Fe3O4. Chọn đáp án C.
Câu 7: Crom không tan được trong dung dịch H2SO4 đặc, nguội. Chọn đáp án A.
Câu 8: Vị trí của Fe trong bảng tuần hoàn là Ô: 26, chu kì: 4, nhóm VIIIB. Chọn đáp án A.
Câu 9: Các số oxi hoá đặc trưng của Crom trong hợp chất là +2, + 3, +6. Chọn đáp án D.
Câu 10: mcr ↓ = mO (oxit) → nO (oxit) = 4,8 : 16 = 0,3 mol.
mFe (oxit) = 16 – 4,8 = 11,2 → nFe (oxit) = 11,2 : 56 = 0,2 mol
Đặt oxit: FexOy có: x : y = nFe (oxit) : nO (oxit) = 2 : 3. Vậy oxit là Fe2O3. Chọn đáp án B.
2. Phần tự luận
Câu 1 (3 điểm): HS viết đúng mỗi PT 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT.
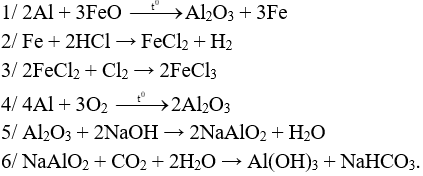
Câu 2 (2 điểm):

Gọi số mol Al, Al2O3 trong hỗn hợp ban đầu lần lượt là a và b (mol)
→ 27a + 102b = 1,56 (1)
Kết tủa sau khi nung là Al2O3: 0,02 mol → 0,5a + b = 0,02 (2)
Từ (1) và (2) → a = 0,02 và b = 0,01
→ nkhí = 0,03 mol → Vkhí = 0,03.22,4 = 6,72 lít.
Câu 3 (2 điểm):
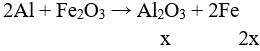
Theo bài ra Y gồm: Al2O3, Fe, Al dư
Gọi số mol Al2O3, Fe, Al dư trong mỗi phần lần lượt là x, y, z (mol)
→ y = 2x → 2x – y = 0 (1)
Phần 1:
Bảo toàn e: 2y + 3z = 0,275 (2)
Phần 2:
Bảo toàn e: 3z = 0,075 (3)
Giải hệ được: x = 0,05; y = 0,1; z = 0,025
Bảo toàn khối lượng: m = mY = 2.(0,05.102 + 0,1.56 + 0,025.27) = 22,75 gam.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Môn: Hóa học 12
Thời gian làm bài: phút
(Đề thi số 1)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Cu = 64, Fe = 56, Na = 23, K = 39, Zn = 65, Mg = 24, Ba = 137.
I. Phần trắc nghiệm
Câu 1: Cho 1,44 gam kim loại M (có hoá trị II) tác dụng với dung dịch H2SO4 loãng, dư. Sau phản ứng thu được dung dịch X và 1,344 lít khí (đkc). Kim loại M là
A. Ba.
B. Mg.
C. Zn.
D. Fe.
Câu 2: Chất nào sau đây gây ra tính cứng tạm thời của nước?
A. Ca(HCO3)2.
B. NaOH.
C. CaCl2.
D. HCl.
Câu 3: Nguyên tắc chung được dùng để điều chế kim loại là
A. cho hợp chất chứa ion kim loại tác dụng với chất khử.
B. oxi hoá ion kim loại trong hợp chất thành nguyên tử kim loại.
C. khử ion kim loại trong hợp chất thành nguyên tử kim loại.
D. cho hợp chất chứa ion kim loại tác dụng với chất oxi hoá.
Câu 4: Trường hợp nào sau đây dung dịch từ không màu chuyển sang màu xanh?
A. Nhúng lá nhôm vào dung dịch HCl.
B. Nhúng lá đồng vào dung dịch AgNO3.
C. Thêm vài giọt phenolphtalein vào dung dịch NaOH.
D. Thêm Fe vào dung dịch NH3 đặc.
Câu 5: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO3 1,0M thoát ra a lít NO. Nếu cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1,0M và H2SO4 0,5 M thoát b lít NO. Biết NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. Quan hệ giữa a và b là
A. b = a.
B. b = 2a.
C. 2b = 5a.
D. 2b = 3a.
Câu 6: Cho Cr tác dụng với O2 (to). Sản phẩm thu được là
A. CrO.
B. Cr2O3.
C. Cr3O4.
D. CrO3.
Câu 7: Hòa tan hoàn toàn 10,6 gam muối vô cơ X vào dung dịch H2SO4 loãng dư thu được 2,24 lít một chất khí Y có tỷ khối so với H2 là 22. X là chất nào sau đây?
A. NaHCO3.
B. Na2CO3.
C. K2SO3.
D. KHSO3.
Câu 8: Để hòa tan hoàn toàn 0,1 mol Fe2O3 và 0,1 mol Fe cần tối thiểu bao nhiêu lít dung dịch H2SO4 1M (loãng)?
A. 0,6.
B. 0,5.
C. 0,3.
D. 0,4.
Câu 9: Cu (Z = 29), cấu hình electron nguyên tử của đồng là
A. 1s22s22p63s23p63d94s2.
B. 1s22s22p63s23p63d104s1.
C. 1s22s22p63s23p63d84s3.
D. 1s22s22p63s23p63d104s2.
Câu 10: Tỉ lệ số người chết về bệnh phổi do hút thuốc lá gấp hàng chục lần số người không hút thuốc là. Chất gây nghiện và gây ung thư có trong thuốc lá là
A. nicotin.
B. aspirin.
C. cafein.
D. moocphin.
Câu 11: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
A. sự oxi hóa Fe và sự oxi hóa Cu.
B. sự oxi hóa Fe và sự khử Cu2+.
C. sự khử Fe2+ và sự khử Cu2+.
D. sự khử Fe2+ và sự oxi hóa Cu.
Câu 12: Kim loại M phản ứng được với: dung dịch HCl, dung dịch Cu(NO3)2, dung dịch HNO3 (đặc, nguội). Kim loại M là
A. Fe.
B. Al.
C. Ag.
D. Zn.
Câu 13: Để nhận biết ion Fe2+ trong dung dịch ta dùng dung dịch
A. NaCl.
B. KOH.
C. K2SO4.
D. NaNO3.
Câu 14: Cho 5,6 gam Fe tác dụng với HNO3 đặc, nóng, dư, thu được V lít khí NO2 (sản phẩm khử duy nhất ở đktc). Giá trị của V là
A. 3,36.
B. 6,72.
C. 1,493.
D. 2,24.
Câu 15: Cho dãy các chất: NH4Cl, (NH4)2SO4, NaCl, MgCl2, FeCl2, AlCl3. Số chất trong dãy tác dụng với lượng dư dung dịch Ba(OH)2 tạo thành kết tủa là
A. 4.
B. 1.
C. 5.
D. 3.
II. Phần tự luận
Câu 1 (1,5 điểm): Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau: NaCl, AlCl3, MgCl2 đựng trong các bình riêng biệt, mất nhãn.
Câu 2 (2 điểm): Cho hỗn hợp X gồm: Fe, ZnO và MgSO3 vào dung dịch H2SO4 (loãng, dư) thu được dung dịch Y và khí Z.
- Cho Z lội qua nước vôi trong dư thu được chất rắn G.
- Cho dd NaOH dư vào dung dịch Y thu được kết tủa Q và dung dịch R. Nung Q ngoài không khí đến khối lượng không đổi được chất rắn T. Biết các phản ứng xảy ra hoàn toàn. Xác định các chất có trong Y, Z, G, Q, R, T và viết các PTHH xảy ra.
Câu 3 (2 điểm): Nung nóng 46,6 gam hỗn hợp gồm Al và Cr2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn. Chia hỗn hợp thu được sau phản ứng thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 300 ml dung dịch NaOH 1M (loãng), sau phản ứng thấy thoát ra V lít khí ở đktc. Để hòa tan hết phần hai cần vừa đủ dung dịch chứa a mol HCl. Tính giá trị của a và V.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Đ/a | B | A | C | B | B | B | B | C | B | A | B | D | B | B |
Câu 1: Bảo toàn e: 2.nM = 2.nkhí → nM = 0,06 mol → MM = 1,44 : 0,06 = 24. Vậy M là Mg. Chọn đáp án B.
Câu 2: Ca(HCO3)2 gây ra tính cứng tạm thời của nước. Chọn đáp án A.
Câu 3: Nguyên tắc chung được dùng để điều chế kim loại là khử ion kim loại trong hợp chất thành nguyên tử kim loại. Chọn đáp án C.
Câu 4: Cu + 2AgNO3 (không màu) → Cu(NO3)2 (xanh) + 2Ag. Chọn đáp án B.
Câu 5:
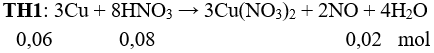
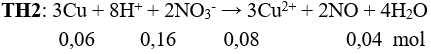
a : b = 0,02 : 0,04 = 1 : 2. Chọn đáp án B.
Câu 6: 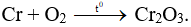
Câu 7: Mkhí = 2.22 = 44 → Loại đáp án C và D.
Giả sử A đúng:
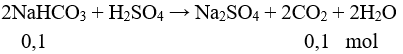
→ mmuối X = 0,1.84 = 8,4 gam ≠ 10,6 gam. Vậy A sai. Chọn đáp án B.
Câu 8:
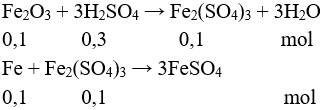
Vaxit = 0,3 lít. Chọn đáp án C.
Câu 9: Cu (Z = 29): 1s22s22p63s23p63d104s1. Chọn đáp án B.
Câu 10: Chất gây nghiện và gây ung thư có trong thuốc lá là nicotin. Chọn đáp án A.
Câu 11: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra sự oxi hóa Fe và sự khử Cu2+. Chọn đáp án B.
Câu 12: Kim loại Zn phản ứng được với: dung dịch HCl, dung dịch Cu(NO3)2, dung dịch HNO3 (đặc, nguội). Chọn đáp án D.
Câu 13: Để nhận biết ion Fe2+ trong dung dịch ta dùng dung dịch KOH. Hiện tượng: xuất hiện kết tủa màu trắng hơi xanh, hóa nâu đỏ trong không khí. Chọn đáp án B.
Câu 14: Bảo toàn e: 3.nFe = nkhí = 0,3 → Vkhí = 0,3.22,4 = 6,72 lít. Chọn đáp án B.
Câu 15: (NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3 + 2H2O
MgCl2 + Ba(OH)2 → BaCl2 + Mg(OH)2 ↓
FeCl2 + Ba(OH)2 → BaCl2 + Fe(OH)2 ↓. Chọn đáp án D.
2. Phần tự luận
Câu 1 (1,5 điểm): Đánh số thứ thự từng lọ, trích mỗi lọ một ít dung dịch sang ống nghiệm đánh số tương ứng.
Chọn dung dịch NaOH làm thuốc thử.
Ống nghiệm nào xuất hiện kết tuả keo trắng, kết tủa tan khi thêm lượng dư NaOH là AlCl3.
Ống nghiệm nào xuất hiện kết tủa trắng, không tan khi dư NaOH là MgCl2.
Ống nghiệm nào không có hiện tượng xảy ra là NaCl.
PTHH:
3NaOH + AlCl3 → Al(OH)3 ↓+ 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
Câu 2 (2 điểm): Fe + H2SO4 → FeSO4 + H2
ZnO + H2SO4 → ZnSO4 + H2O
MgSO3 + H2SO4 → MgSO4 + SO2 + H2O
dd Y gồm: Fe SO4; ZnSO4; MgSO4 và H2SO4 dư
Khí Z gồm H2 và SO2
Z + dd nước vôi trong dư:
SO2 + Ca(OH)2 → CaSO3 + H2O
Vậy G là CaSO3
Y + dd NaOH dư
2NaOH + H2SO4 → Na2SO4 + 2H2O
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
MgSO4 + 2NaOH → Mg(OH)2 ↓ + Na2SO4
ZnSO4 + 2NaOH → Zn(OH)2 ↓ + Na2SO4
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
Kết tủa Q gồm: Mg(OH)2 và Fe(OH)2
dd R gồm: Na2SO4, Na2ZnO2, NaOH dư
Nung Q ngoài không khí
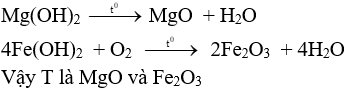
Câu 3 (2 điểm):
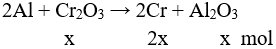
Theo bài ra Al dư, Đặt nCr2O3 pư = x mol, nAl dư = y mol
→ 52.2x + 102.x + 27y = 46,6 : 2
→ 206x + 27y = 23,3
Phần 1 :
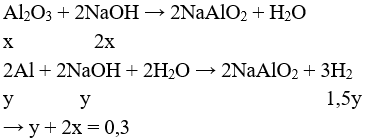
Giải hệ được : x = 0,1 mol; y = 0,1 mol
→ chất rắn mối phần chứa 0,2 mol Cr; 0,1 mol Al; 0,1 mol Al2O3.
Bảo toàn điện tích có:
nHCl = nCl- = 3.nAl3+ + 2.nCr+ = 3.2.0,1 + 3.0,1 + 2.0,2 = 1,3 mol
V = 0,15.22,4 = 3,36 lít.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
....................................
....................................
....................................
Trên đây là phần tóm tắt một số đề thi trong các bộ đề thi Hóa học 12 năm 2024 Học kì 1 và Học kì 2, để xem đầy đủ mời quí bạn đọc lựa chọn một trong các bộ đề thi ở trên!

