Đề thi Học kì 2 Hóa học lớp 8 năm 2024 có ma trận (8 đề)
Với Đề thi Học kì 2 Hóa học lớp 8 năm 2024 có ma trận (8 đề), chọn lọc giúp học sinh ôn tập và đạt kết quả cao trong bài thi Học kì 2 Hóa học 8.
Đề thi Học kì 2 Hóa học lớp 8 năm 2024 có ma trận (8 đề)
Với Đề thi Học kì 2 Hóa học lớp 8 năm 2024 có ma trận (8 đề), chọn lọc giúp học sinh ôn tập và đạt kết quả cao trong bài thi Học kì 2 Hóa học 8.
Đề kiểm tra học kì II – Môn: Hóa học 8
Năm học 2021 – 2022
(Thời gian 45 phút, không kể thời gian giao đề)
A. Ma trận đề
TT |
Nội dung kiến thức |
Đơn vị kiến thức |
Mức độ nhận thức |
Tổng |
||||
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng ở mức độ cao hơn |
Số câu |
% Tổng điểm |
|||
1 |
Oxi – Không khí |
Tính chất vật lý, hóa học, ứng dụng và điều chế oxi. |
1 |
1 |
1 |
1 |
4 |
13,33 |
Oxit |
1 |
1 |
0 |
0 |
2 |
6,67 |
||
Không khí – Sự cháy |
0 |
1 |
0 |
0 |
1 |
3,33 |
||
2 |
Hiđro – Nước |
Tính chất vật lý, hóa học, ứng dụng và điều chế hiđro và nước |
1 |
1 |
1 |
1 |
4 |
13,33 |
Axit, bazơ, muối |
2 |
1 |
0 |
0 |
3 |
10,00 |
||
3 |
Phản ứng hóa học |
Phản ứng hóa học, phản ứng phân hủy, phản ứng thế, phản ứng oxi hóa khử |
0 |
2 |
0 |
0 |
2 |
6,67 |
4 |
Dung dịch – Nồng độ dung dịch |
Dung dịch, chất tan, dung môi, độ tan. |
2 |
2 |
2 |
0 |
6 |
20 |
Nồng độ mol |
1 |
1 |
1 |
1 |
7 |
23,33 |
||
Nồng độ phần trăm |
1 |
1 |
1 |
|||||
Pha chế dung dịch |
0 |
1 |
0 |
0 |
1 |
3,33 |
||
Tổng số câu |
9 |
12 |
6 |
3 |
30 |
100% |
||
Tỉ lệ % |
30 |
40 |
20 |
10 |
100% |
|||
Tỉ lệ chung (%) |
70 |
30 |
100% |
|||||
B. Đề minh họa
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023 - 2024
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Chất nào sau đây không phản ứng với khí oxi?
A. Nước. B. Lưu huỳnh.
C. Khí metan. D. Sắt.
Câu 2: Oxit phi kim nào dưới đây không phải là oxit axit?
A. SO2. B. SO3. C. NO. D. P2O5.
Câu 3: Công thức tính nồng độ mol của dung dịch là
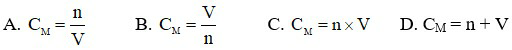
Câu 4: Phát biểu nào sau đây đúng?
A. Sự cháy là sự oxi hóa có tỏa nhiệt.
B. Sự cháy là sự oxi hóa có tỏa nhiệt và phát sáng.
C. Sự cháy là sự oxi hóa có tỏa nhiệt và không phát sáng.
D. Sự cháy là sự oxi hóa có khí và kết tủa tạo thành.
Câu 5: Chất có khả năng hòa tan chất khác để tạo thành dung dịch được gọi là
A. chất oxi hóa. B. chất khử.
C. dung môi. D. chất tan.
Câu 6: Trong 200 ml dung dịch có hòa tan 8,5 gam NaNO3. Nồng độ mol của dung dịch là
A. 0,2M. B. 0,3M. C. 0,4M. D. 0,5M.
Câu 7: Phân tử axit gồm có
A. một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (– OH).
B. một hay nhiều nguyên tử hiđro liên kết với gốc axit, các nguyên tử hiđro này có thể thay thế bằng các nguyên tử kim loại.
C. một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit.
D. một hay nhiều nguyên tử hiđro liên kết với một nguyên tử phi kim.
Câu 8: Phản ứng nào dưới đây không phải là phản ứng thế?
A. CuO + H2 Cu + H2O.
Cu + H2O.
B. Mg + 2HCl → MgCl2 + H2.
C. Ca(OH)2 + CO2 CaCO3 + H2O.
CaCO3 + H2O.
D. Zn + CuSO4 → ZnSO4 + Cu.
Câu 9: Chất tan là
A. hỗn hợp đồng nhất của dung môi và chất tan.
B. chất bị hòa tan trong dung môi.
C. chất có khả năng tác dụng với nước.
D. chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Câu 10: Để pha chế được 50 gam dung dịch CuSO4 có nồng độ 10% ta thực hiện như sau
A. hoà tan 5 gam CuSO4 vào cốc đựng 50 gam nước cất, khuấy nhẹ.
B. hoà tan 5 gam CuSO4 vào cốc đựng 45 gam nước cất, khuấy nhẹ.
C. hoà tan 8 gam CuSO4 vào cốc đựng 45 gam nước cất, khuấy nhẹ.
D. hoà tan 8 gam CuSO4 vào cốc đựng 50 gam nước cất, khuấy nhẹ.
Câu 11: Tại sao người ta dùng phương pháp đẩy nước để thu khí oxi?
A. Oxi mạnh hơn nước.
B. Oxi tan nhiều trong nước.
C. Khối lượng riêng của oxi nặng hơn nước.
D. Oxi ít tan trong nước.
Câu 12: Công thức Fe2O3 có tên gọi là gì?
A. Sắt oxit. B. Sắt (II) oxit.
C. Sắt (III) oxit. D. Sắt từ oxit.
Câu 13: Chất nào sau đây là axit?
A. H2SO4. B. NaCl. C. Ba(OH)2. D. MgSO4.
Câu 14: Cho phương trình hóa học: 2Al + Fe2O3 Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
A. sự oxi hóa, sự khử.
B. sự khử, sự oxi hóa.
C. sự phân hủy, sự khử.
D. sự oxi hóa, sự phân hủy.
Câu 15: Hỗn hợp đồng nhất của dung môi và chất tan được gọi là
A. dung dịch. B. dung môi.
C. chất tan. D. kiềm.
Câu 16: Nồng độ mol của dung dịch cho biết
A. số gam dung môi có trong 100 gam dung dịch.
B. số gam chất tan có trong 100 gam dung dịch.
C. số mol chất tan có trong một lít dung dịch.
D. số mol chất tan có trong dung dịch.
Câu 17: Phát biểu nào sau đây không đúng?
A. Khí hiđro là chất khí không màu, không mùi, không vị.
B. Khí hiđro nhẹ nhất trong các chất khí.
C. Khí hiđro tan nhiều trong nước.
D. Khí hiđro nhẹ hơn không khí.
Câu 18: Cho 4,6 gam Na tác dụng với nước dư. Sau phản ứng thu được V lít khí (ở đktc). Giá trị của V là
A. 2,24. B. 1,12. C. 3,36. D. 4,48.
Câu 19: Cho một thìa nhỏ đường vào cốc nước, khuấy nhẹ. Đường tan trong nước tạo thành dung dịch đường. Chất tan là
A. nước đường. B. nước.
C. nước và đường. D. đường.
Câu 20: Công thức tính nồng độ phần trăm là
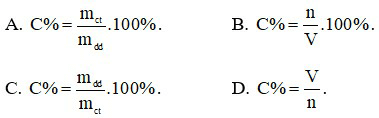
Câu 21: Đốt cháy hoàn toàn 2,24 lít khí CH4 trong bình chứa khí oxi. Thể tích khí oxi (đo ở đktc) cần dùng là
A. 2,24 lít. B. 3,36 lít. C. 4,48 lít. D. 6,72 lít.
Câu 22: Cho 4,48 lít khí hiđro tác dụng với 3,36 lít khí oxi. Biết các thể tích khí đo ở đktc. Số gam nước thu được là
A. 3,6 gam. B. 1,8 gam. C. 2,7 gam. D. 4,5 gam.
Câu 23: Tên gọi của các chất có công thức hóa học: HCl, NaOH, Al2(SO4)3 lần lượt là
A. axit clohiđric, natri hiđroxit, nhôm (III) sunfat.
B. axit cloric, natri hiđroxit, nhôm sunfat.
C. axit clohiđric, natri (I) hiđroxit, nhôm (III) sunfat.
D. axit clohiđric, natri hiđroxit, nhôm sunfat.
Câu 24: Ở nhiệt độ phòng thí nghiệm (khoảng 20oC), 10 gam nước có thể hòa tan tối đa 3,6 gam muối ăn. Chọn khối lượng của muối ăn để tạo ra dung dịch bão hòa với 10 gam nước.
A. 4,0 gam. B. 3,2 gam. C. 3,0 gam. D. 2,8 gam.
Câu 25: Nồng độ phần trăm của một dung dịch cho ta biết
A. số mol chất tan trong một lít dung dịch.
B. số gam chất tan có trong 100 gam dung dịch.
C. số mol chất tan có trong 150 gam dung dịch.
D. số gam chất tan có trong dung dịch.
Câu 26: Nếu đốt cháy hoàn toàn 2,4 gam cacbon trong 4,8 gam oxi thì thu được tối đa bao nhiêu gam khí CO2?
A. 6,6 gam. B. 6,5 gam. C. 6,4 gam. D. 6,3 gam.
Câu 27: Kim loại nào sau đây tác dụng được với nước ở nhiệt độ thường?
A. Mg. B. Cu. C. Fe. D. Na.
Câu 28: Hòa tan 15 gam NaCl vào 55 gam nước. Nồng độ phần trăm của dung dịch là
A. 21,43%. B. 26,12%. C. 28,10%. D. 29,18%.
Câu 29: Để quá trình hòa tan chất rắn trong nước xảy ra nhanh hơn, ta không nên thực hiện biện pháp nào sau đây?
A. Khuấy dung dịch. B. Đun nóng dung dịch.
C. Nghiền nhỏ chất rắn. D. Làm lạnh dung dịch.
Câu 30: Trộn 100 ml dung dịch NaOH 1M với 150 ml dung dịch NaOH aM, thu được dung dịch có nồng độ 1,6M. Giá trị của a là
A. 0,5. B. 1,0. C. 1,5. D. 2,0.
--- Hết ---
Giám thị không giải thích thêm

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023 - 2024
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 2)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Phát biểu nào sau đây về oxi là không đúng?
A. Oxi cần thiết cho sự sống.
B. Oxi không có mùi và không có màu.
C. Oxi là một đơn chất phi kim rất hoạt động, nhất là ở nhiệt độ cao.
D. Oxi tan nhiều trong nước.
Câu 2: Hợp chất nào sau đây không phải là oxit?
A. CO2. B. SO2. C. CuO. D. CuS.
Câu 3: Hoà tan hết 19,5 gam kali vào 261 gam H2O. Nồng độ % của dung dịch thu được là (biết rằng nước bay hơi không đáng kể).
A. 5%. B. 10%. C.15%. D. 20%.
Câu 4: Nồng độ mol/lít của dung dịch là
A. số gam chất tan trong 1 lít dung dịch.
B. số gam chất tan trong 1lít dung môi.
C. số mol chất tan trong 1lít dung dịch.
D. số mol chất tan trong 1lít dung môi.
Câu 5: Để chuyển đổi từ một dung dịch NaCl bão hòa thành một dung dịch chưa bão hòa (ở nhiệt độ phòng). Ta có thể
A. thêm NaCl và khuấy nhẹ.
B. thêm lượng dư nước và khuấy nhẹ đến khi muối ăn đã tan hết.
C. ngâm trong nước lạnh.
D. khuấy liên tục khoảng 5 phút.
Câu 6: Muốn pha 300 ml dung dịch NaCl 3M thì khối lượng NaCl cần lấy là
A. 52,65 gam. B. 54,65 gam. C. 60,12 gam. D. 60,18 gam.
Câu 7: Để tạo ra được 3,6 gam nước thì thể tích khí hiđro và khí oxi (ở đktc) cần tác dụng với nhau lần lượt là
A. 4,48 lít và 4,48 lít. B. 4,48 lít và 2,24 lít.
C. 2,24 lít và 4,48 lít. D. 2,24 lít và 2,24 lít.
Câu 8: Công thức hóa học của sắt (III) hiđroxit là
A. Fe(OH)2. B. Fe2O3. C. Fe(OH)3. D. FeO.
Câu 9: Cho các phản ứng sau:
1) 2FeCl2 + Cl2 2FeCl3
2FeCl3
2) CuO + H2 Cu + H2O
Cu + H2O
3) 2KNO3 2KNO2 + O2
2KNO2 + O2
4) 2Fe(OH)3 Fe2O3 + 3H2O
Fe2O3 + 3H2O
5) CH4 + 2O2 CO2 + 2H2O
CO2 + 2H2O
Số phản ứng phân hủy là
A. 1. B. 2. C. 3. D. 4.
Câu 10: Nồng độ của dung dịch tăng nhanh nhất khi nào?
A. Tăng lượng chất tan đồng thời tăng lượng dung môi.
B. Tăng lượng chất tan đồng thời giảm lượng dung môi.
C. Tăng lượng chất tan đồng thời giữ nguyên lượng dung môi.
D. Giảm lượng chất tan đồng thời giảm lượng dung môi.
Câu 11: Để pha chế được 100 ml dung dịch CuSO4 có nồng độ 2M ta thực hiện như sau:
A. Cân lấy 32 gam CuSO4 vào cốc. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 100 ml dung dịch.
B. Cân lấy 16 gam CuSO4 vào cốc. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 100 ml dung dịch.
C. Cân lấy 32 gam CuSO4 vào cốc. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 150 ml dung dịch.
D. Cân lấy 16 gam CuSO4 vào cốc. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 150 ml dung dịch.
Câu 12: Để điều chế khí hiđro trong phòng thí nghiệm, ta có thể dùng kim loại nhôm tác dụng với
A. CuSO4 hoặc HCl loãng.
B. KClO3 hoặc KMnO4.
C. H2SO4 loãng hoặc HCl loãng.
D. Fe2O3 hoặc CuO.
Câu 13: Nồng độ phần trăm là nồng độ cho biết
A. số gam chất tan có trong 100 gam dung dịch.
B. số gam chất tan có trong 100 gam dung dịch bão hòa.
C. số gam chất tan có trong 100 gam nước.
D. số gam chất tan có trong 1 lít dung dịch.
Câu 14: Thành phần các chất trong không khí gồm
A. 78% nitơ; 1% oxi; 21% các chất khác.
B. 21% nitơ; 78% oxi; 1% các chất khác.
C. 50% nitơ; 50% oxi.
D. 21% oxi; 78% nitơ; 1% các chất khác.
Câu 15: Sự khuấy làm cho chất rắn bị hòa tan nhanh hơn. Vì
A. các phân tử nước chuyển động nhanh hơn, làm tăng số lần va chạm giữa các phân tử nước với bề mặt chất rắn.
B. luôn luôn tạo ra sự tiếp xúc mới giữa chất rắn và các phân tử nước.
C. gia tăng diện tích tiếp xúc giữa chất rắn với các phân tử nước.
D. làm tăng nhiệt độ dung dịch và tăng số lần va chạm giữa các phân tử nước với bề mặt chất rắn.
Câu 16: Công thức tính nồng độ phần trăm là
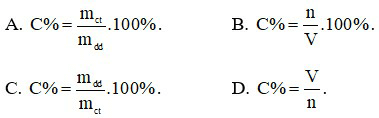
Câu 17: Dãy dung dịch nào dưới đây làm đổi màu quỳ tím thành xanh?
A. KOH, BaCl2, H2SO4, NaOH.
B. NaOH, K2SO4, NaCl, KOH.
C. NaOH, KOH, Ba(OH)2, Ca(OH)2.
D. KOH, Ba(NO3)2, HCl, NaOH.
Câu 18: Trong phản ứng: CuO + H2 Cu + H2O. Chất khử và chất oxi hóa lần lượt là
Cu + H2O. Chất khử và chất oxi hóa lần lượt là
A. CuO, H2. B. H2, CuO.
C. Cu, H2O. D. H2O, Cu.
Câu 19: Phát biểu nào sau đây không đúng?
A. Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan.
B. Kích thước của chất rắn càng nhỏ thì chất rắn bị hòa tan càng nhanh.
C. Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan.
D. Đun nóng dung dịch làm cho chất rắn bị hòa tan chậm hơn.
Câu 20: Tính khối lượng NaOH có trong 200 gam dung dịch NaOH 15%?
A. 20 gam. B. 30 gam. C. 40 gam. D. 50 gam.
Câu 21: Đốt cháy 12,4 gam P trong bình chứa 20 gam khí oxi. Khối lượng P2O5 thu được sau phản ứng là
A. 14,2 gam. B. 32,4 gam. C. 35,5 gam. D. 28,4 gam.
Câu 22: Trong các chất sau: K2O, P2O5, CaO, Na2O. Nước tác dụng được với chất nào tạo ra axit?
A. P2O5 B. Na2O C. K2O D. CaO
Câu 23: Trộn 2 ml rượu etylic (cồn) với 20 ml nước cất. Phát biểu nào sau đây là đúng?
A. Nước là chất tan, rượu etylic là dung môi.
B. Rượu etylic là chất tan, nước là dung môi.
C. Nước hoặc rượu etylic có thể là chất tan hoặc dung môi.
D. Cả hai chất nước và rượu etylic vừa là chất tan, vừa là dung môi.
Câu 24: Khí oxi phản ứng được với chất nào cho dưới đây?
A. SO3. B. Na2O. C. CaO. D. CH4.
Câu 25: Dãy chỉ gồm các oxit axit là
A. CO, CO2, SO2, Al2O3.
B. CO2, SO2, SO3, P2O5.
C. FeO, SiO2, CaO, Fe2O3.
D. Na2O, BaO, H2O, ZnO.
Câu 26: Kim loại không tan trong nước là
A. Na. B. K. C. Ca. D. Cu.
Câu 27: Cho các chất sau: H2SO3, KOH, FeCl3, Na2CO3, Ca(OH)2, HNO3, CuSO4. Số axit, bazơ và muối lần lượt là
A. 3, 2, 2. B. 2, 3, 2.
C. 2, 2, 3. D. 1, 3, 3.
Câu 28: Ở nhiệt độ phòng thí nghiệm (khoảng 20oC), 10 gam nước có thể hòa tan tối đa 20 gam đường. Chọn khối lượng của đường để tạo ra dung dịch chưa bão hòa với 10 gam nước.
A. 22 gam. B. 18 gam. C. 25 gam. D. 28 gam.
Câu 29: Khi phân hủy có xúc tác 15,8 gam KMnO4, thể tích khí oxi thu được ở đktc là
A. 3,36 lít. B. 11,2 lít. C. 1,12 lít. D. 33,6 lít.
Câu 30: Cho một thìa nhỏ đường vào cốc nước, khuấy nhẹ. Đường tan trong nước tạo thành dung dịch đường. Chất tan là
A. nước đường. B. nước.
C. đường. D. nước và đường.
--- Hết ---
Giám thị không giải thích thêm
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023 - 2024
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 3)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Phương pháp điều chế khí oxi trong phòng thí nghiệm là
A. Đun nóng KMnO4 hoặc KClO3 ở nhiệt độ cao.
B. Đi từ không khí.
C. Điện phân nước.
D. Nhiệt phân CaCO3.
Câu 2: Dung dịch là hỗn hợp:
A. của nước và chất lỏng.
B. của chất rắn trong chất lỏng.
C. của hai chất lỏng.
D. đồng nhất của dung môi và chất tan.
Câu 3: Nồng độ mol của dung dịch là
A. Số gam chất tan trong 1 lít dung dịch.
B. Số gam chất tan trong 1lít dung môi.
C. Số mol chất tan trong 1lít dung dịch.
D. Số mol chất tan trong 1 lít dung môi.
Câu 4: Có 3 oxit sau: MgO, P2O5, Na2O. Có thể nhận biết được các chất đó bằng thuốc thử nào sau đây?
A. Chỉ dùng nước.
B. Chỉ dùng dung dịch kiềm.
C. Chỉ dùng axit.
D. Dùng nước và giấy quỳ.
Câu 5: Với một lượng chất tan xác định khi tăng thể tích dung môi thì
A. C% tăng, CM tăng. B. C% giảm, CM giảm.
C. C% tăng, CM giảm. D. C% giảm, CM tăng.
Câu 6: Độ tan của một chất trong nước ở nhiệt độ xác định là
A. Số gam chất đó có thể tan trong 100 gam dung dịch.
B. Số gam chất đó có thể tan trong 100 gam nước.
C. Số gam chất đó có thể tan trong 100 gam dung môi để tạo thành dung dịch bão hòa.
D. Số gam chất đó có thể tan trong 100 gam nước để tạo thành dung dịch bão hòa.
Câu 7: Khối lượng nước cần dùng để pha chế 150 gam dung dịch NaCl 5% từ dung dịch NaCl 10% là
A. 56,8 gam. B. 67,5 gam. C. 60,8 gam. D. 59,4 gam.
Câu 8: Dãy chất nào sau đây đều tác dụng với nước ở nhiệt độ thường?
A. K, BaO, SO2. B. K, CaO, ZnO.
C. Na, Cu, SO3. D. CaO, CuO, P2O5.
Câu 9: Hòa tan 6 gam NaOH vào nước được 0,5 lít dung dịch NaOH. Dung dịch này có nồng độ mol là
A. 1,0M. B. 0,2M. C. 0,3M. D. 0,5M.
Câu 10: Dãy các bazơ nào sau đây là bazơ tan?
A. KOH, NaOH, Ca(OH)2, Ba(OH)2.
B. KOH, NaOH, Cu(OH)2, Mg(OH)2.
C. Al(OH)3, Ca(OH)2, NaOH, Mg(OH)2.
D. Ba(OH)2, KOH, Zn(OH)2, Cu(OH)2.
Câu 11: Hai chất không thể hòa tan với nhau tạo thành dung dịch là
A. Nước và đường. B. Dầu ăn và xăng.
C. Rượu và nước. D. Dầu ăn và cát.
Câu 12: 25 gam dung dịch muối ăn, nồng độ 10% có chứa một lượng muối ăn là
A. 4,5 gam. B. 5,5 gam. C. 4,0 gam. D. 2,5 gam.
Câu 13: Cho các phản ứng hóa học sau:
(1) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
(2) K2O + H2O → 2KOH
(3) Zn + H2SO4 → ZnSO4 + H2↑
(4) CuO + 2HCl → CuCl2 + H2O
(5) Mg + CuCl2 → MgCl2 + Cu
(6) HCl + NaOH → NaCl + H2O
Số phản ứng thuộc loại phản ứng thế là
A. 2. B. 3. C. 4. D. 5.
Câu 14: Ở 20oC, hòa tan 20,7 gam CuSO4 vào 100 gam nước thì được một dung dịch CuSO4 bão hòa. Vậy độ tan của CuSO4 trong nước ở 20oC là
A. 120,7 gam. B. 100 gam. C. 20,7 gam. D. 20 gam.
Câu 15: Ý nghĩa 98% trong bình đựng dung dịch H2SO4 là
A. 98 gam H2SO4 có trong 100 gam dung dịch.
B. 98 gam H2SO4 có trong 100 gam nước.
C. 98 gam H2SO4 có trong 1 lít dung dịch.
D. 98 gam H2SO4 có trong 100 ml dung môi.
Câu 16: Sự oxi hóa có tỏa nhiệt nhưng không phát sáng được gọi là
A. sự oxi hóa chậm. B. sự khử.
C. sự khử chậm. D. sự cháy.
Câu 17: Có thể điều chế được bao nhiêu gam O2 từ 31,6 gam KMnO4?
A. 1,6 gam. B. 16 gam. C. 3,2 gam. D. 6,4 gam.
Câu 18: Nhận xét nào sau đây đúng về oxi?
A. Oxi là chất khí tan vô hạn trong nước và nặng hơn không khí.
B. Oxi là chất khí ít tan trong nước và nặng hơn không khí.
C. Oxi là chất khí không duy trì sự cháy, hô hấp.
D. Oxi là chất khí không tan trong nước và nặng hơn không khí.
Câu 19: Cho nổ một hỗn hợp gồm 2 mol H2 và 24 lít khí oxi (ở đktc). Chất khí nào còn dư và dư bao nhiêu lít sau phản ứng?
A. O2 dư; 1,4 lít. B. H2 dư; 1,6 lít.
C. H2 dư; 1,4 lít. D. O2 dư; 1,6 lít.
Câu 20: Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước
A. đều giảm.
B. đều tăng.
C. có thể tăng và có thể giảm.
D. không tăng và cũng không giảm.
Câu 21: Để tính nồng độ phần trăm của dung dịch NaOH, người ta làm thế nào ?
A. Tính số gam NaOH có trong 100 gam dung dịch.
B. Tính số gam NaOH có trong 1 lít dung dịch.
C. Tính số gam NaOH có trong 100 gam nước.
D. Tính số mol NaOH có trong 1 lít dung dịch
Câu 22: Dãy hợp chất nào sau đây chỉ gồm các hợp chất axit?
A. NaOH; KCl; HCl. B. HCl; CuSO4; NaOH.
C. HCl; H2SO4; HNO3. D. H2SO4; NaCl; Cu(OH)2.
Câu 23: Công thức Fe2O3 có tên gọi là gì?
A. Sắt oxit. B. Sắt (II) oxit.
C. Sắt (III) oxit. D. Sắt từ oxit.
Câu 24: Khi cho dòng điện một chiều đi qua nước, trên bề mặt 2 điện cực sẽ sinh ra
A. khí hiđro và khí oxi.
B. khí hiđro và khí cacbon oxit.
C. khí oxi và khí cacbon oxit.
D. khí hiđro và khí clo.
Câu 25: Trộn 100 ml dung dịch NaOH 1M với 150 ml dung dịch NaOH aM, thu được dung dịch có nồng độ 1,6M. Giá trị của a là
A. 0,5. B. 1,0. C. 1,5. D. 2,0.
Câu 26: Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
A. C + O2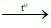 CO2.
CO2.
B. Fe2O3 + 3CO 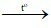 2Fe + 3CO2.
2Fe + 3CO2.
C. CaCO3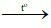 CaO + CO2.
CaO + CO2.
D. 3Fe + 2O2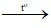 Fe3O4.
Fe3O4.
Câu 27: Cho dần dần và liên tục đường vào cốc nước, khuấy nhẹ. Ở giai đoạn đầu ta được dung dịch đường, dung dịch này vẫn có thể hòa tan thêm đường. Ở giai đoạn sau ta được một dung dịch đường không thể hòa tan thêm đường gọi là
A. dung dịch đường chưa bão hòa.
B. dung dịch đường trung tính.
C. dung dịch đường bão hòa.
D. dung dịch đường kém bão hòa.
Câu 28: Trong dãy các chất sau, dãy gồm các chất làm quỳ tím chuyển màu đỏ là
A. dung dịch KMnO4, dung dịch NaCl.
B. dung dịch Ca(OH)2, dung dịch KOH.
C. dung dịch HCl, dung dịch H2SO4.
D. dung dịch NaCl, H2O.
Câu 29: Đốt cháy 3,1 gam photpho trong bình chứa 11,2 lít khí oxi (đktc). Sau phản ứng trong bình có những chất nào?
A. Photpho và khí oxi.
B. Photpho, khí oxi và điphotpho pentaoxit.
C. Photpho và điphotpho pentaoxit.
D. Khí oxi và điphotpho pentaoxit.
Câu 30: Phát biểu nào sau đây không đúng?
A. Khí hiđro là chất khí không màu, không mùi, không vị.
B. Khí hiđro nhẹ nhất trong các chất khí.
C. Khí hiđro tan nhiều trong nước.
D. Khí hiđro nhẹ hơn không khí.
--- Hết ---
Giám thị không giải thích thêm
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023 - 2024
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 4)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Trong phòng thí nghiệm, oxi được điều chế từ 2 chất nào sau đây?
A. CuO; Fe3O4. B. KMnO4; KClO3.
C. Không khí; H2O. D. KMnO4; MnO2.
Câu 2: Trong số những dung dịch dưới đây, dung dịch nào làm cho quỳ tím không đổi màu?
A. HNO3. B. NaOH. C. NaCl. D. Ca(OH)2.
Câu 3: Khí oxi không tác dụng được với chất nào sau đây?
A. Fe. B. S. C. P. D. Ag.
Câu 4: Chất tan là
A. hỗn hợp đồng nhất của dung môi và chất tan.
B. chất bị hòa tan trong dung môi.
C. chất có khả năng tác dụng với nước.
D. chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Câu 5: Muốn pha 400 ml dung dịch CuSO4 0,2M thì khối lượng CuSO4 cần lấy là
A. 10,8 gam. B. 12,8 gam. C. 5,04 gam. D. 10 gam.
Câu 6: Đốt nóng CuO tới khoảng 400oC rồi cho luồng khí H2 đi qua. Trong phản ứng trên, hiđro thể hiện
A. tính khử.
B. tính oxi hóa.
C. tính khử và tính oxi hóa.
D. không có tính khử và không có tính oxi hóa.
Câu 7: Sự cháy và sự oxi hoá chậm có điểm chung là đều
A. toả nhiệt và phát sáng
B. toả nhiệt và không phát sáng.
C. xảy ra sự oxi hoá và có toả nhiệt.
D. xảy ra sự oxi hoá và không phát sáng.
Câu 8: Nồng độ mol của dung dịch là
A. số gam chất tan trong 1 lít dung dịch.
B. số gam chất tan trong 1 lít dung môi.
C. số mol chất tan trong 1 lít dung dịch.
D. số mol chất tan trong 1 lít dung môi.
Câu 9: Tên gọi của H2SO3 là
A. Hiđrosunfua. B. Axit sunfuric.
C. Axit sunfuhiđric. D. Axit sunfurơ.
Câu 10: Hòa tan 14,36 gam NaCl vào 40 gam nước ở nhiệt độ 20oC thì thu được dung dịch bão hòa. Độ tan của NaCl ở nhiệt độ đó là
A. 35,5 gam. B. 35,9 gam. C. 36,5 gam. D. 37,2 gam.
Câu 11: Số mol chất tan có trong 400 ml NaOH 6M là
A. 1,2 mol. B. 2,4 mol. C. 1,5 mol. D. 4 mol.
Câu 12: Phản ứng nào sau đây là phản ứng phân hủy?
A. 4P + 5O2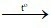 2P2O5
2P2O5
C. 2Fe(OH)3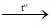 Fe2O3 + 3H2O
Fe2O3 + 3H2O
C. 2CO + O2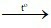 2CO2
2CO2
D. 2Cu + O2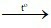 2CuO
2CuO
Câu 13: Cần thêm bao nhiêu ml nước vào 100 ml dung dịch Ca(OH)2 0,5M để thu được dung dịch mới có nồng độ 0,1M?
A. 400 ml. B. 300 ml. C. 200 ml. D. 100 ml.
Câu 14: Dãy oxit nào có tất cả các oxit đều tác dụng được với nước?
A. SO3, CaO, CuO, Fe2O3.
B. SO3, Na2O, CaO, P2O5.
C. ZnO, CO2, SiO2, PbO.
D. SO2, Al2O3, HgO, K2O.
Câu 15: Công thức tính nồng độ phần trăm của dung dịch là
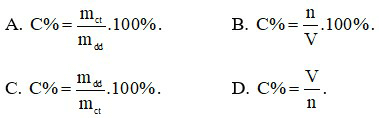
Câu 16: Cho 4,48 lít khí hiđro tác dụng với 3,36 lít khí oxi. Biết các thể tích khí đo ở đktc. Số gam nước thu được là
A. 3,6 gam. B. 1,8 gam. C. 2,7 gam. D. 4,5 gam.
Câu 17: Trong phản ứng hóa học giữa khí H2 và CuO ở nhiệt độ cao đã xảy ra
A. sự oxi hóa H2 tạo thành H2O.
B. sự khử H2 tạo thành H2O.
C. sự oxi hoá CuO tạo ra Cu.
D. sự phân hủy CuO thành Cu.
Câu 18: Dung dịch không thể hòa tan thêm chất tan là
A. Dung môi.
B. Dung dịch bão hòa.
C. Dung dịch chưa bão hòa.
D. Cả A và B.
Câu 19: Số gam NaCl trong 50 gam dung dịch NaCl 40% là
A. 40 gam. B. 30 gam. C. 20 gam. D. 50 gam.
Câu 20: Muốn điều chế được 2,8 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là
A. 19,75 gam. B. 39,5 gam. C. 59,25 gam. D. 9,875 gam
Câu 21: Oxit nào sau đây tác dụng với nước tạo thành bazơ?
A. CaO. B. SO3. C. Al2O3. D. CuO.
Câu 22: Cho 4,6 gam Na tác dụng với nước dư. Sau phản ứng thu được V lít khí (ở đktc). Giá trị của V là
A. 2,24. B. 1,12. C. 3,36. D. 4,48.
Câu 23: Dung dịch là
A. hỗn hợp gồm dung môi và chất tan.
B. hợp chất gồm dung môi và chất tan.
C. hỗn hợp đồng nhất gồm nước và chất tan.
D. hỗn hợp đồng nhất gồm dung môi và chất tan.
Câu 24: Tính khối lượng NaOH có trong 200 gam dung dịch NaOH 15%?
A. 20 gam. B. 30 gam. C. 40 gam. D. 50 gam.
Câu 25: Hợp chất Na2SO4 có tên gọi là
A. natri sunfat. B. natri sunfit.
C. sunfat natri. D. natri sunfuric.
Câu 26: Ở một nhiệt độ xác định, dung dịch bão hòa là dung dịch
A. không thể hòa tan thêm chất tan.
B. có thể hòa tan thêm chất tan.
C. có thể hòa tan nhiều chất tan cùng một lúc.
D. không thể hòa tan nhiều chất tan cùng một lúc.
Câu 27: Đốt cháy 6 gam oxi và 6,2 gam P trong bình. Sau phản ứng chất nào còn dư?
A. Cả hai chất đều hết. B. Photpho.
C. Cả hai chất đều dư. D. Oxi.
Câu 28: Tên gọi của P2O5 là
A. Điphotpho trioxit. B. Photpho oxit.
C. Điphotpho pentaoxit. D. Điphotpho oxit.
Câu 29: Để quá trình hòa tan chất rắn trong nước xảy ra nhanh hơn, ta không nên thực hiện biện pháp nào sau đây?
A. Khuấy dung dịch. B. Đun nóng dung dịch.
C. Nghiền nhỏ chất rắn. D. Làm lạnh dung dịch.
Câu 30: Khi cô cạn 199 ml dung dịch CuSO4 thu được 43,2 gam CuSO4. Biết khối lượng riêng của dung dịch là 1,206 g/ml. Nồng độ phần trăm của dung dịch trên là
A. 18%. B. 20%. C. 24%. D. 28%.
--- Hết ---
Giám thị không giải thích thêm
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023 - 2024
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 5)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Phát biểu nào sau đây về oxi là không đúng?
A. Oxi là phi kim hoạt động hoá học rất mạnh, nhất là ở nhiệt độ cao.
B. Oxi tạo oxit axit với hầu hết kim loại.
C. Oxi không có mùi và không vị.
D. Oxi cần thiết cho sự sống.
Câu 2: Phương trình hóa học của phản ứng hiđro khử sắt (III) oxit là
A. FeO + H2 Fe + H2O.
Fe + H2O.
B. Fe2O3 + 3H2 2Fe + 3H2O.
2Fe + 3H2O.
C. Fe3O4 + 4H2 3Fe + 4H2O.
3Fe + 4H2O.
D. 2Fe + 3H2O 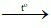 Fe2O3 + 3H2.
Fe2O3 + 3H2.
Câu 3: Trộn 5 ml rượu etylic (cồn) với 10 ml nước cất. Câu nào sau đây diễn đạt đúng?
A. Chất tan là rượu, dung môi là nước.
B. Chất tan là nước, dung môi là rượu.
C. Nước hoặc rượu etylic có thể là chất tan hoặc là dung môi.
D. Cả 2 chất nước và rượu etylic vừa là chất tan vừa là dung môi.
Câu 4: Thêm 6 gam NaCl vào 200 gam dung dịch NaCl 12%. Dung dịch thu được có nồng độ phần trăm là
A. 13,78%. B. 14,56%. C. 15,12%. D. 16,52%.
Câu 5: Để pha chế được 100 ml dung dịch H2SO4 1M từ dung dịch H2SO4 2M thì thể tích nước cất cần thêm vào là
A. 100 ml. B. 80 ml. C. 60 ml. D. 50 ml.
Câu 6: Dung dịch axit làm quỳ tím chuyển sang màu
A. xanh. B. đen. C. tím. D. đỏ.
Câu 7: Chọn phát biểu đúng trong các câu sau đây về thành phần của không khí?
A. 21% nitơ, 78% oxi, 1% các khí khác (CO2, CO, khí hiếm, …)
B. 21% các khí khác, 78% khí nitơ, 1% khí oxi.
C. 21% khí oxi, 78% khí nitơ, 1% các khí khác (CO2, CO, khí hiếm, …)
D. 21% khí oxi, 78% các khí khác, 1% khí nitơ.
Câu 8:Hợp chất nào sau đây không phải là muối?
A. Đồng (II) nitrat. B. Kali clorua.
C. Sắt (II) sunfat. D. Canxi hiđroxit.
Câu 9: Đâu là phản ứng thế trong các phản ứng sau?
A. Fe + 2HCl → FeCl2 + H2↑
B. NaOH + HCl → NaCl + H2O
C. Cu + 2FeCl3 → CuCl2 + 2FeCl2
D. CuO + 2HCl → CuCl2 + H2O
Câu 10: Dung dịch là hỗn hợp
A. Của chất rắn trong chất lỏng.
B. Của chất khí trong chất lỏng.
C. Đồng nhất của chất rắn và dung môi.
D. Đồng nhất của dung môi và chất tan.
Câu 11: Trong phòng thí nghiệm, cần điều chế 4,48 lít khí O2 (đktc) thì dùng chất nào sau đây làm để có lợi nhất?
A. KClO3. B. KMnO4. C. KNO3. D. Không khí.
Câu 12: Cho 120 ml dung dịch HCl 2M, khối lượng HCl trong dung dịch là
A. 7,30 gam. B. 8,76 gam. C. 9,49 gam. D. 10,95 gam.
Câu 13: Có 4 lọ mất nhãn đựng 4 chất bột màu trắng gồm: CaO, Na2O, MgO và P2O5. Dùng thuốc thử nào để nhận biết các chất trên?
A. Dùng nước và dung dịch H2SO4.
B. Dùng dung dịch H2SO4 và phenolphtalein.
C. Dùng nước và giấy quì tím.
D. Không có chất nào thử được.
Câu 14: Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước thay đổi như thế nào?
A. Không thay đổi. B. Giảm.
C. Có thể tăng hoặc giảm. D. Tăng.
Câu 15: Để tạo ra được 3,6 gam nước thì thể tích khí hiđro và khí oxi (ở đktc) cần tác dụng với nhau lần lượt là
A. 4,48 lít và 4,48 lít. B. 4,48 lít và 2,24 lít.
C. 2,24 lít và 4,48 lít. D. 2,24 lít và 2,24 lít.
Câu 16: Phản ứng oxi hóa – khử là phản ứng trong đó
A. xảy ra đồng thời sự oxi hóa và sự khử.
B. chỉ xảy ra sự oxi hóa.
C. chỉ xảy ra sự khử.
D. không xảy ra sự oxi hóa và sự khử.
Câu 17: Trong 200 ml dung dịch có hòa tan 8,5 gam NaNO3. Nồng độ mol của dung dịch là
A. 0,2M. B. 0,3M. C. 0,4M. D. 0,5M.
Câu 18: Trong phòng thí nghiệm, muốn chuyển đổi dung dịch NaCl bão hòa thành một dung dịch chưa bão hòa, ta cần
A. cho thêm muối. B. cho thêm nước.
C. khuấy dung dịch. D. đun nóng dung dịch.
Câu 19: Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất nào của oxi?
A. Khí oxi tan trong nước.
B. Khí oxi ít tan trong nước.
C. Khí oxi khó hóa lỏng.
D. Khí oxi nhẹ hơn nước.
Câu 20: Khử 10,85 gam thủy ngân (II) oxit bằng khí hiđro. Thể tích khí hiđro (ở đktc) cần dùng là
A. 2,24 lít. B. 1,12 lít. C. 3,36 lít. D. 4,48 lít.
Câu 21: Nồng độ mol của dung dịch cho biết
A. số gam dung môi có trong 100 gam dung dịch.
B. số gam chất tan có trong 100 gam dung dịch.
C. số mol chất tan có trong một lít dung dịch.
D. số mol chất tan có trong dung dịch.
Câu 22:Thành phần phân tử của bazơ gồm
A. một nguyên tử kim loại và một hay nhiều nhóm –OH.
B. một nguyên tử kim loại và nhiều nhóm –OH.
C. một hay nhiều nguyên tử kim loại và một hay nhiều nhóm –OH.
D. một hay nhiều nguyên tử kim loại và nhiều nhóm –OH.
Câu 23: Khi hoà tan 100 ml rượu etylic vào 50 ml nước thì
A. nước và rượu đều là chất tan.
B. nước là chất tan và rượu là dung môi.
C. rượu là chất tan và nước là dung môi.
D. nước và rượu đều là dung môi.
Câu 24: Tính thể tích không khí (có chứa 20% O2) ở đktc cần dùng để đốt cháy vừa đủ 2,4 gam cacbon?
A. 4,48 lít. B. 22,4 lít. C. 11,2 lít. D. 0,896 lít.
Câu 25: Nồng độ phần trăm của một dung dịch cho ta biết
A. số mol chất tan trong một lít dung dịch.
B. số gam chất tan có trong 100 gam dung dịch.
C. số mol chất tan có trong 150 gam dung dịch.
D. số gam chất tan có trong dung dịch.
Câu 26: Chỉ ra các oxit bazơ trong dãy oxit sau: P2O5, CaO, CuO, BaO, Na2O, SO3.
A. CaO, CuO, BaO, Na2O. B. P2O5, CaO, CuO.
C. BaO, Na2O, SO3. D. P2O5, CaO, SO3.
Câu 27: Độ tan của NaCl trong nước là 25°C là 36 gam. Khi mới hòa tan 15 gam NaCl vào 50 gam nước thì phải hòa tan thêm bao nhiêu gam NaCl để được dung dịch bão hòa?
A. 3 gam. B. 18 gam. C. 5 gam. D. 9 gam.
Câu 28: Hòa tan 15 gam NaCl vào 55 gam nước. Nồng độ phần trăm của dung dịch là
A. 21,43%. B. 26,12%. C. 28,10%. D. 29,18%.
Câu 29: Ứng dụng nào sau đây không phải của khí hiđro?
A. Dùng làm nhiên liệu cho động cơ tên lửa.
B. Dùng để bơm vào khinh khí cầu, bóng thám không.
C. Dùng trong đèn xì oxi-hiđro để hàn cắt kim loại.
D. Dùng để dập tắt đám cháy.
Câu 30: Nồng độ của dung dịch tăng nhanh nhất khi nào?
A. Tăng lượng chất tan đồng thời tăng lượng dung môi.
B. Tăng lượng chất tan đồng thời giảm lượng dung môi.
C. Tăng lượng chất tan đồng thời giữ nguyên lượng dung môi.
D. Giảm lượng chất tan đồng thời giảm lượng dung môi.
--- Hết ---
Giám thị không giải thích thêm
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023 - 2024
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 6)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Trong thí nghiệm điều chế khí oxi, tại sao người ta thu khí oxi bằng phương pháp đẩy nước?
A. Khí oxi nhẹ hơn nước.
B. Khí oxi tan rất nhiều trong nước.
C. Khí O2 tan ít trong nước.
D. Khí oxi hóa lỏng ở - 183oC.
Câu 2: Cách đọc tên nào sau đây sai?
A. CO2: cacbon (II) oxit. B. CuO: đồng (II) oxit.
C. FeO: sắt (II) oxit. D. CaO: canxi oxit.
Câu 3: Cho hai thí nghiệm sau:
Thí nghiệm 1: Cho một luồng khí H2 (sau khi đã kiểm tra sự tinh khiết) đi qua bột đồng (II) oxit CuO có màu đen ở nhiệt độ thường.
Thí nghiệm 2: Đốt nóng CuO tới khoảng 400oC rồi cho luồng khí H2 đi qua.
Phát biểu nào sau đây không đúng?
A. Thí nghiệm 1: Không có phản ứng hóa học xảy ra.
B. Thí nghiệm 2: Bột CuO màu đen chuyển dần thành màu đỏ gạch.
C. Không có hiện tượng gì ở cả hai thí nghiệm.
D. Thí nghiệm 2: Có những giọt nước tạo thành.
Câu 4: Nồng độ của dung dịch tăng nhanh nhất khi nào?
A. Tăng lượng chất tan đồng thời tăng lượng dung môi.
B. Tăng lượng chất tan đồng thời giảm lượng dung môi.
C. Tăng lượng chất tan đồng thời giữ nguyên lượng dung môi.
D. Giảm lượng chất tan đồng thời giảm lượng dung môi.
Câu 5: Phản ứng nào dưới đây không phải là phản ứng thế?
A. CuO + H2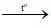 Cu + H2O
Cu + H2O
B. Mg + 2HCl → MgCl2 + H2↑
C. Ca(OH)2 + CO2 → CaCO3↓ + H2O
D. Zn + CuSO4 → ZnSO4 + Cu
Câu 6: Ở 20oC, hòa tan m gam KNO3 vào 95 gam nước thì được dung dịch bão hòa. Biết độ tan của KNO3 ở nhiệt độ 20oC là 42,105 gam. Giá trị của m là
A. 40. B. 44. C. 42. D. 43.
Câu 7: Ý nghĩa 98% trong bình đựng dung dịch H2SO4 là
A. 98 gam H2SO4 có trong 100 gam dung dịch.
B. 98 gam H2SO4 có trong 100 gam nước.
C. 98 gam H2SO4 có trong 1 lít dung dịch.
D. 98 gam H2SO4 có trong 100 ml dung môi.
Câu 8: Sự giống nhau giữa sự cháy và sự oxi hóa chậm là
A. Phát sáng. C. Tỏa nhiệt.
C. Sự oxi hóa xảy ra chậm. D. Cháy.
Câu 9: Các câu sau, câu nào đúng khi định nghĩa dung dịch?
A. Dung dịch là hỗn hợp đồng nhất của chất rắn và chất lỏng.
B. Dung dịch là hỗn hợp đồng nhất của chất khí và chất lỏng.
C. Dung dịch là hỗn hợp đồng nhất của hai chất lỏng.
D. Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi.
Câu 10: Tính thể tích khí oxi phản ứng khi đốt cháy 3,6 gam C?
A. 0,672 lít. B. 67,2 lít. C. 6,72 lít. D. 0,0672 lít.
Câu 11: Cho các chất sau: FeO (1), KClO3 (2), KMnO4 (3), CaCO3 (4), không khí (5), H2O (6). Những chất nào được dùng để điều chế oxi trong phòng thí nghiệm?
A. 2, 3, 5, 6. A. 2, 3.
C. 1, 2, 3, 5. D. 2, 3, 5.
Câu 12: Hòa tan 50 gam NaCl vào 450 gam nước thì thu được dung dịch có nồng độ là A. 15%. B. 20%. C. 10%. D. 5%.
Câu 13: Chọn câu đúng khi nói về độ tan. Độ tan của một chất trong nước ở nhiệt độ xác định là
A. Số gam chất đó tan trong 100 gam dung dịch.
B. Số gam chất đó tan trong 100 gam nước để tạo dung dịch bão hoà.
C. Số gam chất đó tan trong nước tạo ra 100 gam dung dịch.
D. Số gam chất đó tan trong 100 gam dung môi.
Câu 14: Cho 4,48 lít khí hiđro tác dụng với 3,36 lít khí oxi. Biết các thể tích khí đo ở đktc. Số gam nước thu được là
A. 3,6 gam. B. 1,8 gam. C. 2,7 gam. D. 4,5 gam.
Câu 15: Hoà tan 4 gam NaOH vào nước để được 400 ml dung dịch. Nồng độ mol của dung dịch thu được là
A. 0,22M. B. 0,23M. C. 0,24M. D. 0,25M.
Câu 16: Dãy dung dịch nào dưới đây làm đổi màu quỳ tím thành đỏ?
A. HCl, H2SO4, HNO3, NaCl.
B. HCl, H2SO4, Ba(NO3)2, NaOH.
C. Ba(OH)2, Na2SO4, H3PO4, HNO3.
D. HCl, H2SO4, H3PO4, HNO3.
Câu 17: Cho dần dần và liên tục muối ăn vào cốc nước, khuấy nhẹ. Sau một thời gian, thấy còn một lượng muối ăn không tan ở đáy cốc. Dung dịch thu được là
A. dung dịch chưa bão hòa. B. dung dịch axit.
C. dung dịch bão hòa. D. dung dịch bazơ.
Câu 18: Để tính nồng độ mol của dung dịch NaOH, người ta làm thế nào?
A. Tính số gam NaOH có trong 100 gam dung dịch.
B. Tính số gam NaOH có trong 1 lít dung dịch.
C. Tính số gam NaOH có trong 1000 gam dung dịch.
D. Tính số mol NaOH có trong 1 lít dung dịch.
Câu 19: Muốn pha 250 ml dung dịch NaOH nồng độ 0,5M từ dung dịch NaOH 2M thì thể tích dung dịch NaOH 2M cần lấy là
A. 62,5 ml. B. 67,5 ml. C. 68,6 ml. D. 69,4 ml.
Câu 20: Cho phương trình hóa học của phản ứng: Fe2O3 + 3H2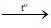 2Fe + 3H2O. Phát biểu đúng là
2Fe + 3H2O. Phát biểu đúng là
A. Phản ứng hóa học trên không là phản ứng oxi hóa – khử.
B. Phản ứng hóa học trên là phản ứng oxi hóa – khử; Fe2O3 là chất oxi hóa, H2 là chất khử.
C. Phản ứng hóa học trên là phản ứng oxi hóa – khử; Fe2O3 là chất khử, H2 là chất oxi hóa.
D. Phản ứng hóa học trên là phản ứng phân hủy.
Câu 21: Sự khuấy làm cho chất rắn bị hòa tan nhanh hơn. Vì
A. các phân tử nước chuyển động nhanh hơn, làm tăng số lần va chạm giữa các phân tử nước với bề mặt chất rắn.
B. luôn luôn tạo ra sự tiếp xúc mới giữa chất rắn và các phân tử nước.
C. gia tăng diện tích tiếp xúc giữa chất rắn với các phân tử nước.
D. làm tăng nhiệt độ dung dịch và tăng số lần va chạm giữa các phân tử nước với bề mặt chất rắn.
Câu 22: Trong 200 ml dung dịch có hòa tan 8,5 gam NaNO3. Nồng độ mol của dung dịch là
A. 0,2M. B. 0,3M. C. 0,4M. D. 0,5M.
Câu 23: Số gam KMnO4 cần dùng để điều chế được 2,24 lít khí oxi (đktc) là
A. 20,7 gam. B. 42,8 gam. C. 14,3 gam. D. 31,6 gam.
Câu 24: Oxit bazơ không tác dụng với nước là
A. BaO. B. Na2O. C. CaO. D. MgO.
Câu 25: Trường hợp nào sau đây không có sự phù hợp giữa tên gọi và công thức hóa học?
A. HNO3: axit nitric.
B. CuSO4: đồng (II) sunfat.
C. Fe2O3: sắt (III) oxit.
D. FeS: sắt sunfua.
Câu 26: Làm sao để quá trình hòa tan chất rắn vào nước diễn ra nhanh hơn?
A. khuấy dung dịch. B. đun nóng dung dịch.
C. nghiền nhỏ chất rắn. D. cả ba cách đều được.
Câu 27: Chỉ ra các oxit bazơ trong dãy oxit sau: P2O5, CuO, BaO, Na2O, SO3.
A. CaO, CuO, Na2O. B. P2O5, CaO, CuO.
C. CaO, Na2O, SO3. D. P2O5, CaO, SO3.
Câu 28: Hòa tan 11,28 gam K2O vào nước dư, thu được m gam KOH. Tính m?
A. 6,72 gam. B. 13,44 gam. C. 8,4 gam. D. 8,96 gam
Câu 29: Cho các chất sau: H2SO3, KOH, FeCl3, Na2CO3, Ca(OH)2, HNO3, CuSO4. Số axit, bazơ và muối lần lượt là
A. 3, 2, 2. B. 2, 3, 2. C. 2, 2, 3. D. 1, 3, 3.
Câu 30: Tên gọi của chất có công thức hóa học H2SO4 là
A. axit sunfuric. B. axit sunfurơ.
C. axit sunfuhiđric. D. axit lưu huỳnh.
--- Hết ---
Giám thị không giải thích thêm
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023 - 2024
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 7)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Tại sao trong phòng thí nghiệm người ta lại điều chế oxi bằng cách nhiệt phân KClO3 hay KMnO4 hoặc KNO3?
A. Dễ kiếm, giá thành rẻ.
B. Giàu oxi và dễ phân huỷ ra oxi.
C. Phù hợp với thiết bị máy móc hiện đại.
D. Không độc hại, dễ sử dụng.
Câu 2: Dẫn 2,24 lít khí H2 qua ống sứ nung nóng đựng 4 gam CuO. Khối lượng Cu thu được là
A. 3,2 gam. B. 0,32 gam. C. 1,6 gam. D. 6,4 gam.
Câu 3: Tên gọi của chất có công thức hóa học H2SO4 là
A. axit sunfuric. B. axit sunfurơ.
C. axit sunfuhiđric. D. axit lưu huỳnh.
Câu 4: Cho dung dịch NaOH 4M có D = 1,43 g/ml. Tính C% của dung dịch NaOH đã cho?
A. 11,88%. B. 12,20%. C. 11,19%. D. 11,79%.
Câu 5: Bằng cách nào sau đây có thể pha chế được dung dịch NaCl 15%?
A. Hoà tan 15 gam NaCl vào 90 gam H2O.
B. Hoà tan 15 gam NaCl vào 100 gam H2O.
C. Hoà tan 30 gam NaCl vào 170 gam H2O.
D. Hoà tan 15 gam NaCl vào 190 gam H2O.
Câu 6: Trong phòng thí nghiệm, muốn chuyển đổi dung dịch NaCl bão hòa thành một dung dịch chưa bão hòa, ta cần
A. cho thêm muối. B. cho thêm nước.
C. khuấy dung dịch. D. đun nóng dung dịch.
Câu 7: Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 3,2 gam metan là
A. 4,48 lít. B. 5,60 lít. C. 8,96 lít. D. 2,24 lít
Câu 8: Khí oxi không tác dụng được với chất nào sau đây?
A. Fe. B. S. C. P. D. Ag.
Câu 9: Điều kiện phát sinh phản ứng cháy là
A. Chất phải nóng đến nhiệt độ cháy.
B. Phải đủ khí oxi cho sự cháy.
C. Cần phải có chất xúc tác cho phản ứng cháy.
D. Cả A và B.
Câu 10: Khi hoà tan 100 ml rượu etylic vào 50 ml nước thì
A. nước và rượu đều là chất tan.
B. nước là chất tan và rượu là dung môi.
C. rượu là chất tan và nước là dung môi.
D. nước và rượu đều là dung môi.
Câu 11: Cho các chất sau: H2SO4, HCl, NaCl, CuSO4, NaOH, Mg(OH)2. Số chất thuộc loại axit là
A. 1 B. 2 C. 3 D. 4
Câu 12: Hoà tan 4 gam NaOH vào nước, thu được 200 ml dung dịch. Nồng độ mol của dung dịch NaOH là
A. 0,5M. B. 0,1M. C. 0,2M. D. 0,25M.
Câu 13: Phản ứng phân hủy là
A. Ba + 2HCl → BaCl2 + H2↑
B. Zn + 2HCl → ZnCl2 + H2 ↑
C. CaO + CO2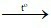 CaCO3
CaCO3
D. 2KMnO4 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
Câu 14: Hòa tan 14,36 gam NaCl vào 40 gam nước ở nhiệt độ 20oC thì thu được dung dịch bão hòa. Độ tan của NaCl ở nhiệt độ đó là
A. 35,5 gam. B. 35,9 gam. C. 36,5 gam. D. 37,2 gam.
Câu 15: Tính khối lượng của Ba(OH)2 có trong 300 ml dung dịch Ba(OH)2 0,4M.
A. 27,36 gam. B. 2,052 gam. C. 20,52 gam. D. 9,474 gam
Câu 16: Nước được cấu tạo bởi:
A. 1 nguyên tử hiđro và 1 nguyên tử oxi.
B. 2 nguyên tử hiđro và 1 nguyên tử oxi.
C. 1 nguyên tử hiđro và 2 nguyên tử oxi.
D. 2 nguyên tử hiđro và 2 nguyên tử oxi.
Câu 17: Dãy các oxit axit là
A. SiO2, CO, CO2, P2O5, Al2O3.
B. SiO2, CO2, SO3, P2O5, N2O5.
C. FeO, CO, SO2, P2O5, Al2O3.
D. NO, CO2, CO, SiO2, P2O5.
Câu 18: Những chất tác dụng với nước tạo thành dung dịch bazơ là
A. SO3, Na2O, BaO. B. CaO, CuO, Fe2O3.
C. CaO, BaO, CuO. D. Na2O, K2O, BaO.
Câu 19: Nồng độ mol của dung dịch cho biết
A. số gam dung môi có trong 100 gam dung dịch.
B. số gam chất tan có trong 100 gam dung dịch.
C. số mol chất tan có trong một lít dung dịch.
D. số mol chất tan có trong dung dịch.
Câu 20: Đốt cháy 12,4 gam photpho trong bình chứa 13,44 lít khí oxi (đktc). Sau phản ứng, chất nào còn dư (photpho hay oxi) và số mol chất còn dư là bao nhiêu?
A. P dư; 0,15 mol. B. P dư; 0,1 mol.
C. O2 dư; 0,15 mol. D. O2 dư; 0,1 mol.
Câu 21: Trong số những chất có công thức hoá học dưới đây, chất nào làm cho quỳ tím không đổi màu?
A. HNO3. B. NaOH. C. Ca(OH)2. D. NaCl
Câu 22: Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 vào dung dịch Ca(OH)2.
(2) Cho khí H2 qua sắt (III) oxit nung nóng.
(3) Đốt cháy Fe trong bình đựng khí Cl2.
(4) Sục khí SO2 vào dung dịch KOH.
Số thí nghiệm có xảy ra phản ứng oxi hóa – khử là
A. 1. B. 2. C. 3. D. 4.
Câu 23: Khi tăng nhiệt độ thì độ tan của chất rắn trong nước thay đổi như thế nào?
A. Đều tăng. B. Đều giảm.
C. Phần lớn là tăng. D. Phần lớn là giảm.
Câu 24: Phát biểu nào sau đây không đúng?
A. Có chất không tan và có chất tan trong nước.
B. Có chất tan nhiều, có chất tan ít trong nước.
C. Dung dịch là hỗn hợp đồng chất của chất tan và dung môi.
D. Dung môi là chất bị hòa tan trong nước.
Câu 25: Một dung dịch H2SO4 có nồng độ 12%. Khối lượng H2SO4 có trong 200 gam dung dịch là
A. 12 gam. B. 20 gam. C. 24 gam. D. 48 gam.
Câu 26: Có 3 oxit sau: MgO, P2O5, Na2O. Có thể nhận biết được các chất đó bằng thuốc thử nào sau đây?
A. Chỉ dùng nước.
B. Chỉ dùng dung dịch kiềm.
C. Chỉ dùng axit.
D. Dùng nước và giấy quỳ.
Câu 27: Để tính nồng độ phần trăm của dung dịch NaOH, người ta làm thế nào ?
A. Tính số gam NaOH có trong 100 gam dung dịch.
B. Tính số gam NaOH có trong 1 lít dung dịch.
C. Tính số gam NaOH có trong 100 gam nước.
D. Tính số mol NaOH có trong 1 lít dung dịch.
Câu 28: Cho 6,9 gam Na tác dụng với nước dư. Sau phản ứng thu được V lít khí (ở đktc). Giá trị của V là
A. 2,24. B. 1,12. C. 3,36. D. 4,48.
Câu 29: Độ tan kí hiệu là
A. T. B. S. C. V. D. M.
Câu 30: Trong 225 ml nước có hoà tan 25 gam KNO3. Nồng độ phần trăm của dung dịch là
A. 10%. B. 11%. C. 12%. D. 13%.
--- Hết ---
Giám thị không giải thích thêm
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023 - 2024
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 8)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Người ta thu khí oxi bằng phương pháp đẩy nước là do
A. khí oxi nhẹ hơn nước.
B. khí oxi tan nhiều trong nước.
C. khí oxi tan ít trong nước.
D. khí oxi khó hoá lỏng.
Câu 2: Chất nào sau đây là oxit axit?
A. SO2. B. Al2O3. C. HCl. D. BaCO3.
Câu 3: Ở 25oC độ tan của đường là 204 gam. Nghĩa là
A. 100 gam nước ở 25oC hòa tan tối đa được 204 gam.
B. 150 gam nước ở 25oC hòa tan tối đa được 204 gam.
C. 1000 gam nước ở 25oC hòa tan tối đa được 204 gam.
D. 204 gam nước ở 25oC hòa tan tối đa được 100 gam.
Câu 4: Hoà tan 124 gam Na2O vào 876 ml nước, phản ứng tạo ra NaOH. Nồng độ phần trăm của dung dịch thu được là
A. 16%. B. 17%. C. 18%. D. 19%.
Câu 5: Đốt cháy hoàn toàn 56 lít khí hiđro (ở đktc) với 44,8 lít khí oxi. Khối lượng nước thu được là
A. 45 gam. B. 36 gam. C. 24 gam. D. 18 gam.
Câu 6: Công thức của bạc clorua là
A. AgCl2. B. Ag2Cl. C. Ag2Cl3. D. AgCl.
Câu 7: Cho những biến đổi hóa học sau:
(1) Nung nóng canxi cacbonat.
(2) Sắt tác dụng với lưu huỳnh.
(3) Khí CO đi qua đồng (II) oxit nung nóng.
Những biến đổi hóa học trên thuộc loại phản ứng nào?
A. (1) và (3) là phản ứng oxi hóa – khử, (2) là phản ứng hóa hợp.
B. (1) là phản ứng phân hủy, (2) là phản ứng hóa hợp, (3) là phản ứng oxi hóa – khử.
C. (1) là phản ứng phân hủy, (2) là phản ứng oxi hóa – khử, (3) là phản ứng hóa hợp.
D. (1) là phản ứng hóa hợp, (2) và (3) là phản ứng oxi hóa – khử.
Câu 8: Biết độ tan của AgNO3 ở 25oC là 222 gam. Khối lượng AgNO3 có thể tan trong 150 gam nước ở 25oC là
A. 555 gam. B. 444 gam. C. 333 gam. D. 222 gam.
Câu 9: Ý nghĩa 98% trong bình đựng dung dịch H2SO4 là
A. 98 gam H2SO4 có trong 100 gam dung dịch.
B. 98 gam H2SO4 có trong 100 gam nước.
C. 98 gam H2SO4 có trong 1 lít dung dịch.
D. 98 gam H2SO4 có trong 100 ml dung môi.
Câu 10: Khi phân huỷ có xúc tác 122,5 gam KClO3, thể tích khí oxi thu được là
A. 33,6 lít. B. 3,36 lít. C. 11,2 lít. D. 1,12 lít.
Câu 11: Cho mẩu Na vào cốc nước dư thấy có 4,48 lít khí bay lên ở đktc. Tính khối lượng Na phản ứng
A. 9,2 gam. B. 4,6 gam. C. 2 gam. D. 9,6 gam.
Câu 12: Làm thế nào để dập tắt sự cháy?
A. Hạ nhiệt độ của chất cháy xuống dưới nhiệt độ cháy.
B. Cách li chất cháy với oxi.
C. Quạt.
D. A và B đều đúng.
Câu 13: Cho các bazơ sau: natri hiđroxit, bari hiđroxit, sắt (II) hiđroxit, đồng (II) hiđroxit, canxi hiđroxit, nhôm hiđroxit. Số các bazơ không tan trong nước là
A. 2. B. 3. C. 4. D. 5.
Câu 14: Chất tan là
A. hỗn hợp đồng nhất của dung môi và chất tan.
B. chất bị hòa tan trong dung môi.
C. chất có khả năng tác dụng với nước.
D. chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Câu 15: Nồng độ của dung dịch tăng nhanh nhất khi nào?
A. Tăng lượng chất tan đồng thời tăng lượng dung môi.
B. Tăng lượng chất tan đồng thời giảm lượng dung môi.
C. Tăng lượng chất tan đồng thời giữ nguyên lượng dung môi.
D. Giảm lượng chất tan đồng thời giảm lượng dung môi.
Câu 16: Axit nitric là tên gọi của axit nào sau đây?
A. H3PO4. B. HNO3. C. HNO2. D. H2SO3.
Câu 17: Phản ứng nào sau đây là phản ứng thế?
A. 3CO + Fe2O3  2Fe + 3CO2.
2Fe + 3CO2.
B. Fe + CuCl2  FeCl2 + Cu.
FeCl2 + Cu.
C. 2KClO3  2KCl + 3O2↑.
2KCl + 3O2↑.
D. CaO + CO2 → CaCO3.
Câu 18: Nồng độ mol của dung dịch là
A. số gam chất tan trong 1 lít dung dịch.
B. số gam chất tan trong 1 lít dung môi.
C. số mol chất tan trong 1 lít dung dịch.
D. số mol chất tan trong 1 lít dung môi.
Câu 19: Ở một nhiệt độ xác định, dung dịch bão hòa là dung dịch
A. không thể hòa tan thêm chất tan.
B. có thể hòa tan thêm chất tan.
C. có thể hòa tan nhiều chất tan cùng một lúc.
D. không thể hòa tan nhiều chất tan cùng một lúc.
Câu 20: Khí oxi không tác dụng được với chất nào sau đây?
A. Fe. B. S. C. P. D. Ag.
Câu 21: Dãy gồm các kim loại tác dụng với nước ở nhiệt độ thường là
A. Fe, Mg, Al. B. Fe, Cu, Ag.
C. Zn, Al, Ag. D. Na, K, Ca.
Câu 22: Để quá trình hòa tan chất rắn trong nước xảy ra nhanh hơn, ta không nên thực hiện biện pháp nào sau đây?
A. Khuấy dung dịch. B. Đun nóng dung dịch.
C. Nghiền nhỏ chất rắn. D. Làm lạnh dung dịch.
Câu 23: Số mol trong 400 ml NaOH 6M là
A. 1,2 mol. B. 2,4 mol. C. 1,5 mol. D. 4 mol.
Câu 24: Đốt cháy 6,2 gam P trong bình chứa 6,72 lít khí oxi (đktc) tạo thành P2O5. Chất nào còn dư và dư bao nhiêu?
A. P còn dư 3,72 gam.
B. O2 còn dư 3,72 gam.
C. P còn dư 4,65 gam.
D. O2 còn dư 4,65 gam.
Câu 25: Cho hai thí nghiệm sau:
Thí nghiệm 1: Cho một luồng khí H2 (sau khi đã kiểm tra sự tinh khiết) đi qua bột đồng (II) oxit CuO có màu đen ở nhiệt độ thường.
Thí nghiệm 2: Đốt nóng CuO tới khoảng 400oC rồi cho luồng khí H2 đi qua.
Phát biểu nào sau đây không đúng?
A. Thí nghiệm 1: Không có phản ứng hóa học xảy ra.
B. Thí nghiệm 2: Bột CuO màu đen chuyển dần thành màu đỏ gạch.
C. Không có hiện tượng gì ở cả hai thí nghiệm.
D. Thí nghiệm 2: Có những giọt nước tạo thành.
Câu 26: Phát biểu nào sau đây không đúng?
A. Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan.
B. Kích thước của chất rắn càng nhỏ thì chất rắn bị hòa tan càng nhanh.
C. Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan.
D. Đun nóng dung dịch làm cho chất rắn bị hòa tan chậm hơn.
Câu 27: Trong 150 ml dung dịch có hòa tan 6,39 gam Na2SO4. Nồng độ mol của dung dịch là
A. 0,2M. B. 0,3M. C. 0,4M. D. 0,5M.
Câu 28: Có 80 gam dung dịch KOH 20%. Khối lượng KOH cần thêm vào dung dịch trên để được dung dịch KOH 36% là
A. 20 gam. B. 10 gam. C. 15 gam. D. 25 gam.
Câu 29: Thiếc có thể có hoá trị II hoặc IV. Hợp chất có công thức SnO2 có tên là
A. Thiếc penta oxit. B. Thiếc oxit.
C. Thiếc (II) oxit. D. Thiếc (IV) oxit.
Câu 30: Cho dung dịch HCl 25% có D = 1,198 g/ml. Tính nồng độ mol của dung dịch đã cho?
A. 8M. B. 8,2M. C. 7,9M. D. 6,5M.
--- Hết ---
Giám thị không giải thích thêm
