Bài 15.20, 15.21, 15.22, 15.23, 15.24, 15.25, 15.26, 15.27, 15.28 trang 21 SBT Hóa học 9
Bài 15.20, 15.21, 15.22, 15.23, 15.24, 15.25, 15.26, 15.27, 15.28 trang 21 SBT Hóa học 9
Bài 15.20 trang 21 Sách bài tập Hóa học 9: Dung dịch M có chứa CuSO4 và FeSO4.
a) Cho Al vào dung dịch M, sau phản ứng tạo thành dung dịch N chứa 3 muối tan.
b) Cho Al vào dung dịch M, sau phản ứng tạo thành dung dịch N chứa 2 muối tan.
c) Cho Al vào dung dịch M, sau phản ứng tạo thành dung dịch N chứa 1 muối tan.
Giải thích mỗi trường hợp bằng phương trình hoá học.
Lời giải:
a) 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Dung dịch N sau phản ứng chứa 3 muối tan, như vậy có khả năng phản ứng trên chưa kết thúc hoặc lượng nhôm ít nên dung dịch N chứa 3 muối Al2(SO4)3, CuSO4 dư và FeSO4 chưa phản ứng.
b) Dung dịch N sau phản ứng chứa 2 muối tan, nghĩa là lượng Al đã tác dụng hết với CuSO4, nên dung dịch N chứa 2 muối Al2(SO4)3 và FeSO4 còn dư (hoặc chưa phản ứng).
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu ↓
c) Dung dịch N sau phản ứng chứa 1 muối tan, dung dịch sau phản ứng chỉ có Al2(SO4)3, do Al dư hoặc vừa đủ để phản ứng với 2 muối :
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu ↓
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe ↓
Bài 15.21 trang 21 Sách bài tập Hóa học 9: Cho các dung dịch CuSO4, FeSO4, MgSO4, AgNO3 và các kim loại Cu, Fe, Mg, Ag. Theo em những cặp chất nào (kim loại và muối) phản ứng được với nhau ? Viết các phương trình hoá học.
Lời giải:
- Viết phương trình hoá học của phản ứng giữa Mg với các dung dịch CuSO4, FeSO4 và AgNO3.
- Viết phương trình hoá học của phản ứng giữa Fe với các dung dịch CuSO4, AgNO3.
- Viết phương trình hoá học của phản ứng giữa Cu với dung dịch AgNO3.
Bài 15.22 trang 21 Sách bài tập Hóa học 9: Cho hỗn hợp Al và Fe tác dụng với hỗn hợp dung dịch chứa AgNO3 và Cu(NO3)2 thu được dung dịch B và chất rắn D gồm 3 kim loại. Cho D tác dụng với dung dịch HCl dư, thấy có khí bay lên. Thành phần chất rắn D là :
A. Al, Fe và Cu ; B. Fe, Cu và Ag ;
C. Al, Cu và Ag ; D. Kết quả khác.
Lời giải:
Đáp án B.
Al là kim loại hoạt động hoá học mạnh hơn Fe nên Al phản ứng hết trước. Trường hợp 1 : Al vừa đủ phản ứng, còn Fe không phản ứng và kim loại Ag, Cu được giải phóng.
Al + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
Trường hợp 2 : Al phản ứng hết, sau đó đến Fe phản ứng, Fe dư và kim loại Ag, Cu được giải phóng.
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Chất rắn D gồm Ag, Cu và Fe.
Bài 15.23 trang 21 Sách bài tập Hóa học 9: Chọn 2 chất khử thỏa mãn A trong sơ đồ sau : FexOy + A to→ Fe + ? Viết các phương trình hoá học.
Lời giải:
Hai chất khử thoả mãn A trong sơ đồ là H2, Co :
FexOy + yH2 → xFe + yH20
FexOy + yCO → xFe + yCO2
Bài 15.24 trang 21 Sách bài tập Hóa học 9: Một hỗn hợp gồm CuO, FeO. Chỉ dùng Fe và dung dịch HCl, hãy nêu hai phương pháp (dùng sơ đồ) điều chế Cu nguyên chất.
Lời giải:
(CuO, FeO) H2, to → (Cu,Fe) HCl→ Cu + FeCl2 + HCl dư lọc → Cu
Bài 15.25 trang 21 Sách bài tập Hóa học 9: Cho 10 gam hỗn hợp gồm Fe và Cu tác dụng với dung dịch H2SO4 loãng, dư. Sau phản ứng thu được 2,24 lít khí hiđro (ở đktc), dung dịch X và m gam kim loại không tan. Xác định giá trị của m.
Lời giải:
Phương trình hóa học của phản ứng:
Cu + H2SO4 → Không phản ứng
Fe + H2SO4 → FeSO4 + H2
nH2 = 2,24/22,4 = 0,1 mol
mFe = 0,1 x 56 = 5,6g. Khối lượng Cu không hòa tan là
m = 10 - 5,6 = 4,4g
Bài 15.26 trang 21 Sách bài tập Hóa học 9: Hoà tan 6,5 gam Zn trong dung dịch axit HCl dư, sau phản ứng cô cạn dung dịch thu được một lượng muối khan. Hãy tính lượng muối khan đó.
Lời giải:
Phương trình hóa học của phản ứng:
Zn + 2HCl → ZnCl2 + H2
nZn = 6,5/65 = 0,1 mol
Khối lượng muối thu được là: 0,1 x (65 +71) = 13,6g
Bài 15.27 trang 21 Sách bài tập Hóa học 9: Cho 12,7 gam hợp kim gồm Al, Cu và Mg vào dung dịch HCl dư. Sau phản ứng thu được 11,2 lít khí H2 (ở đktc) và 2,5 gam chất không tan. Xác định thành phần phần trăm khối lượng của hợp kim.
Lời giải:
Cu không tác dụng với axit HCl , do đó chất không tan là Cu và mCu = 2,5 (gam).
Khối lượng Al và Mg bằng : 12,7 - 2,5 = 10,2 (gam)
Phương trình hoá học của phản ứng :
2Al + 6HCl → 2AlCl3 + 3H2
Mg + 2HCl → MgCl2 + H2
Theo phương trình hoá học trên và dữ kiện đề bài cho, ta có :
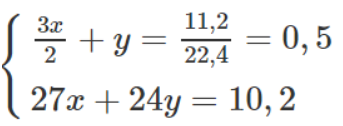
Giải ra, ta có : x = y = 0,2 mol
mAl = 0,2 x 27 = 5,4g
mMg = 0,2 x 24 = 4,8g
%mAl = 5,4/12,7 .100% = 42,52%
%mMg = 4,8/12,7 .100% = 37,8%
%mCu = 100% - 42,52% - 37,8% = 19,68%
Bài 15.28 trang 21 Sách bài tập Hóa học 9: Cho 15 gam hợp kim nhôm - magie vào dung dịch HCl có 15,68 lít hiđro bay ra (ở đktc). Xác định thành phần phần trăm khối lượng của nhôm, magie trong hợp kim.
Lời giải:
Phương trình hoá học của phản ứng :
2Al + 6HCl → 2AlCl3 + 3H2
Mg + 2HCl → MgCl2 + H2
Gọi nAl = a mol
nMg = b mol
Theo phương trình hoá học trên và dữ liệu đề bài, ta có :
27a + 24b = 15
3a/2 + b = 0,7
Giải ra, ta có a = 0,2 (mol); b = 0,4 (mol)
%mAl = 0,2x27/15 x 100% = 36%
%mMg = 0,4 x 24/15 x 100% = 64%

