Trắc nghiệm Hóa học 10 Bài 5 (có đáp án): Lớp, phân lớp và cấu hình electron - Cánh diều
Haylamdo biên soạn và sưu tầm 10 bài tập trắc nghiệm Hóa học 10 Bài 5: Lớp, phân lớp và cấu hình electron sách Cánh diều có đáp án và lời giải chi tiết đầy đủ các mức độ sẽ giúp học sinh ôn luyện trắc nghiệm để biết cách làm các dạng bài tập Hóa 10
Trắc nghiệm Hóa học 10 Bài 5 (có đáp án): Lớp, phân lớp và cấu hình electron - Cánh diều
Câu 1. Electron càng xa hạt nhân thì có năng lượng
A. càng cao.
B. càng thấp.
C. không thay đổi.
D. gấp đôi năng lượng ban đầu.
Câu 2. Các electron thuộc cùng một phân lớp có năng lượng
A. khác nhau.
B. bằng nhau.
C. tăng theo cấp số cộng.
D. tăng theo cấp số nhân.
Câu 3. Số AO và số electron tối đa trong lớp electron thứ n (n ≤ 4) lần lượt là
A. n2; 2n
B. n; 2n2.
C. n2; n2.
D. n2; 2n2.
Câu 4. Lớp electron thứ 3 có bao nhiêu phân lớp và kí hiệu các phân lớp này là gì?
A. 1 phân lớp, kí hiệu là 1s.
B. 2 phân lớp, kí hiệu là 2s và 2p.
C. 3 phân lớp, kí hiệu là 3s, 3p và 3d.
D. 4 phân lớp, kí hiệu là 4s, 4p, 4d và 4f.
Câu 5. Số lượng AO trong mỗi phân lớp s, p, d, f lần lượt là
A. 1, 3, 5, 6.
B. 1, 3, 5, 7.
C. 2, 4, 6, 8.
D. 2, 3, 4, 5.
Câu 6. Số electron tối đa trên mỗi phân lớp ns, np, nd, nf lần lượt là
A. 1, 3, 5, 7.
B. 2, 4, 6, 8.
C. 2, 6, 10, 14.
D. 3, 7, 9, 15.
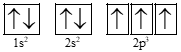
Câu 7. Kí hiệu 1s2 cho biết
A. phân lớp 1s có 2 electron.
B. phân lớp 2s có 1 electron.
C. phân lớp 1s có 2 AO.
D. phân lớp 2s có 1 AO.
Câu 8. Phân lớp được gọi là phân lớp bão hòa khi có
A. 2 electron.
B. 3 electron.
C. tối đa electron.
D. 5 electron.
Câu 9. Phân lớp nào sau đây chưa bão hòa?
A. 1s2.
B. 2p6.
C. 3d8.
D. 4f14.
Câu 10. Lớp ngoài cùng của oxygen (Z = 8) có bao nhiêu electron, bao nhiêu AO?
A. 6 electron và 3 AO.
B. 4 electron và 3 AO.
C. 6 electron và 4 AO.
D. 4 electron và 4 AO.
Câu 11. Nguyên tử Boron (B) có Z = 5. Cấu hình electron của B là
A. 1s22s22p2.
B. 1s22s22p1.
C. 1s22s23s1.
D. 1s22s12p13s1.
Câu 12. Nguyên tử K có Z = 19. Cấu hình electron của K là
A. [Ar]4s1.
B. [Ar]3d1.
C. [Ar]4s2.
D. [Ar]3d2.
Câu 13. Nguyên tử Iron (Fe) có Z = 26. Cấu hình electron của nguyên tử Fe là
A. [Ar]4s23d6.
B. [Ar]3d6.
C. [Ar]3d64s2.
D. [Ar]4s2.
Câu 14. Nguyên tử sodium (Na) có Z = 11. Cấu hình electron của Na+ là
A. 1s22s22p6.
B. 1s22s22p63s1.
C. 1s22s22p63s2.
D. 1s22s22p5.
Câu 15. Nguyên tử nitrogen (Z = 7) có
A. 2 electron độc thân.
B. 3 electron độc thân.
C. 4 electron độc thân.
D. 1 electron độc thân.
Câu 1:
Electron càng xa hạt nhân thì có năng lượng
A. càng cao.
B. càng thấp.
C. không thay đổi.
D. gấp đôi năng lượng ban đầu.
Câu 2:
Các electron thuộc cùng một phân lớp có năng lượng
A. khác nhau.
B. bằng nhau.
C. tăng theo cấp số cộng.
D. tăng theo cấp số nhân.
Câu 3:
Số AO và số electron tối đa trong lớp electron thứ n (n ≤ 4) lần lượt là
A. n2; 2n.
B. n; 2n2.
C. n2; n2.
D. n2; 2n2.
Câu 4:
Lớp electron thứ 3 có bao nhiêu phân lớp và kí hiệu các phân lớp này là gì?
A. 1 phân lớp, kí hiệu là 1s.
B. 2 phân lớp, kí hiệu là 2s và 2p.
C. 3 phân lớp, kí hiệu là 3s, 3p và 3d.
D. 4 phân lớp, kí hiệu là 4s, 4p, 4d và 4f.
Câu 5:
Số lượng AO trong mỗi phân lớp s, p, d, f lần lượt là
A. 1, 3, 5, 6.
B. 1, 3, 5, 7.
C. 2, 4, 6, 8.
D. 2, 3, 4, 5.
Câu 6:
Số electron tối đa trên mỗi phân lớp ns, np, nd, nf lần lượt là
A. 1, 3, 5, 7.
B. 2, 4, 6, 8.
C. 2, 6, 10, 14.
D. 3, 7, 9, 15.
Câu 7:
Kí hiệu 1s2 cho biết
A. phân lớp 1s có 2 electron.
B. phân lớp 2s có 1 electron.
C. phân lớp 1s có 2 AO.
D. phân lớp 2s có 1 AO.
Câu 8:
Phân lớp được gọi là phân lớp bão hòa khi có
A. 2 electron.
B. 3 electron.
C. tối đa electron.
D. 5 electron.
Câu 10:
Lớp ngoài cùng của oxygen (Z = 8) có bao nhiêu electron, bao nhiêu AO?
A. 6 electron và 3 AO.
B. 4 electron và 3 AO.
C. 6 electron và 4 AO.
D. 4 electron và 4 AO.
Câu 11:
Nguyên tử Boron (B) có Z = 5. Cấu hình electron của B là
A. 1s22s22p2.
B. 1s22s22p1.
C. 1s22s23s1.
D. 1s22s12p13s1.
Câu 12:
Nguyên tử K có Z = 19. Cấu hình electron của K là
A. [Ar]4s1.
B. [Ar]3d1.
C. [Ar]4s2.
D. [Ar]3d2.
Câu 13:
Nguyên tử Iron (Fe) có Z = 26. Cấu hình electron của nguyên tử Fe là
A. [Ar]4s23d6.
B. [Ar]3d6.
C. [Ar]3d64s2.
D. [Ar]4s2.
Câu 14:
Nguyên tử sodium (Na) có Z = 11. Cấu hình electron của Na+ là
A. 1s22s22p6.
B. 1s22s22p63s1.
C. 1s22s22p63s2.
D. 1s22s22p5.
Câu 15:
Nguyên tử nitrogen (Z = 7) có
A. 2 electron độc thân.
B. 3 electron độc thân.
C. 4 electron độc thân.
D. 1 electron độc thân.