Lý thuyết Hóa học 10 Kết nối tri thức Bài 11: Liên kết ion
Haylamdo sưu tầm và biên soạn lý thuyết Hóa học lớp 10 Bài 11: Liên kết ion sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Hóa học 10 Kết nối tri thức Bài 11: Liên kết ion
I. Sự tạo thành ion
- Nguyên tử nhường electron tạo thành cation hoặc nhận electron tạo thành anion.
+ Khi cho electron, nguyên tử trở thành ion dương (cation)
Ví dụ:
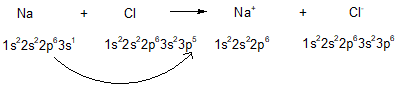
Viết gọn: Na → Na+ + 1e
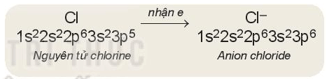
- Khi nhận electron, nguyên tử trở thành ion âm (anion)
Ví dụ:
Viết gọn: Cl + 1e → Cl-
- Chú ý:
+ Số đơn vị điện tích của ion dương (cation) bằng số electron mà nguyên tử nhường.
+ Số đơn vị điện tích của ion âm (anion) bằng số electron mà nguyên tử đã nhận.
+ Các ion thường có cấu hình electron bền vững của nguyên tử khí hiếm gần nhất với nguyên tố tạo thành ion đó trong bảng tuần hoàn.
+ Ngoài các ion được tạo thành từ 1 nguyên tử (ion đơn nguyên tử) như Na+; Cl- … còn có các ion tạo thành từ hai hay nhiều nguyên tử (ion đa nguyên tử), ví dụ: NH4+; OH-; NO3-…
II. Sự tạo thành liên kết ion
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
- Các hợp chất tạo nên từ các ion được gọi là hợp chất ion.
- Ví dụ: Sự hình thành liên kết ion trong phân từ sodium chloride:
Hoặc
III. Tinh thể ion
1. Cấu trúc của tinh thể ion
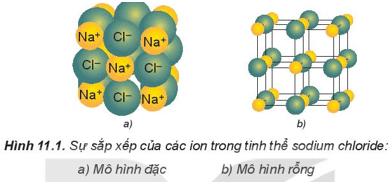
- Cấu trúc của mạng tinh thể ion: Các ion được sắp xếp theo một trật tự xác định trong không gian theo kiểu mạng lưới (ở các nút mạng là các ion dương và ion âm, xếp luân phiên liên kết chặt chẽ với nhau do cân bằng lực hút và lực đẩy).
- Ví dụ: Trong tinh thể sodium chloride, mỗi ion sodium được bao quanh bởi 6 ion chloride gần nhất và mỗi ion chloride cũng được bao quanh bởi 6 ion sodium gần nhất.
- Trong tinh thể ion, số ion cùng dấu bao quanh một ion trái dấu phụ thuộc vào kiểu mạng lưới tinh thể, số điện tích và kích thước của ion.
2. Độ bền và tính chất của các hợp chất ion
- Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
- Do lực hút tĩnh điện rất mạnh giữa các ion nên các tinh thể ion khá rắn, chắc nhưng khá giòn. Đây là tính chất đặc trưng của tinh thể ion.
- Các hợp chất ion thường tan nhiều trong nước.
- Ở trạng thái rắn các hợp chất ion không dẫn điện, tuy nhiên ở trạng thái nóng chảy hoặc khi tan trong nước thì dẫn điện.