Lý thuyết Hóa học 10 Kết nối tri thức Bài 2: Nguyên tố hóa học
Haylamdo sưu tầm và biên soạn lý thuyết Hóa học lớp 10 Bài 2: Nguyên tố hóa học sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Hóa học 10 Kết nối tri thức Bài 2: Nguyên tố hóa học
I. Nguyên tố hóa học
- Nguyên tố hóa học là tập hợp những nguyên tử có cùng số đơn vị điện tích hạt nhân.
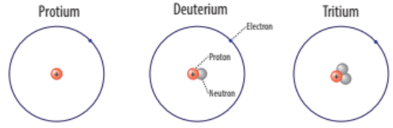
Ví dụ: Protium; deuterium và tritium là các loại nguyên tử của nguyên tố hydrogen.
- Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số electron ở vỏ nguyên tử.
- Các electron trong nguyên tử quyết định tính chất hóa học của nguyên tử, nên các nguyên tử của cùng một nguyên tố hóa học có tính chất hóa học giống nhau.
- Hiện nay, con người đã biết 118 nguyên tố hóa học, trong đó có 94 nguyên tố hóa học tồn tại trong tự nhiên và 24 nguyên tố hóa học được tạo ra trong phòng thí nghiệm.
II. Kí hiệu nguyên tử
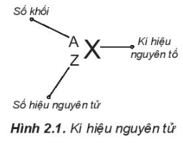
- Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z) của nguyên tố đó) và số khối (A) được xem là những đặc trưng cơ bản của nguyên tử.
- Để kí hiệu nguyên tử, đặt hai chỉ số đặc trưng ở bên trái kí hiệu nguyên tố, trong đó số hiệu nguyên tử Z ở phía dưới, số khối A ở phía trên.
Ví dụ: Kí hiệu cho biết nguyên tử hydrogen có kí hiệu là H; số hiệu nguyên tử là 1 nên trong hạt nhân nguyên tử hydrogen có 1 proton; vỏ nguyên tử có 1 electron; số khối của nguyên tử H là 1, nên trong hạt nhân có số neutron là 1 – 1 = 0. Đây cũng là nguyên tử duy nhất trong hạt nhân không chứa neutron.
III. Đồng vị
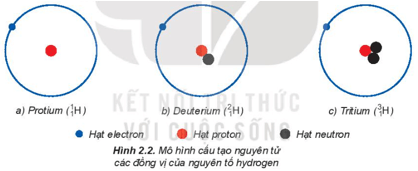
- Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
- Ví dụ: Hydrogen có 3 đồng vị là:
- Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
- Ngoài các đồng vị bền, các nguyên tố hóa học còn có một số đồng vị không bền, gọi là các đồng vị phóng xạ, được sử dụng nhiều trong đời sống, y học, nghiên cứu khoa học…
IV. Nguyên tử khối
1. Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
- Do khối lượng proton và neutron đều xếp xỉ 1 amu, còn khối lượng neutron nhỏ hơn rất nhiều (0,00055 amu), nên một cách gần đúng, coi nguyên tử khối xấp xỉ số khối của hạt nhân.
2. Nguyên tử khối trung bình
- Hầu hết các nguyên tố trong tự nhiên là hỗn hợp của nhiều đồng vị, mỗi đồng vị có tỉ lệ phẩn trăm số nguyên tử xác định.
- Nguyên tử khối của của một nguyên tố là nguyên tử khối trung bình (kí hiệu là ) của hỗn hợp các đồng vị của nguyên tố đó.
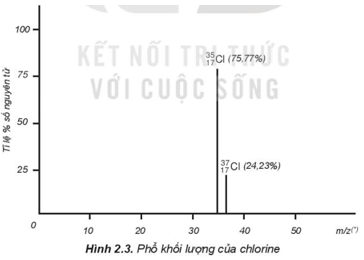
- Muốn xác định giá trị nguyên tử khối trung bình của một nguyên tố, ta cần phải biết được phần trăm số nguyên tử các đồng vị của nguyên tố đó trong tự nhiên. Người ta thường dùng phương pháp phổ khối lượng để xác định phần trăm số nguyên tử các đồng vị tự nhiên của các nguyên tố.
- Công thức tính nguyên tử khối trung bình của nguyên tố :
Trong đó:
: là nguyên tử khối trung bình
X, Y: lần lượt là nguyên tử khối của các đồng vị X, Y,…
a, b: lần lượt là tỉ lệ % số nguyên tử của các đồng vị X, Y.
Ví dụ:
Bằng phương pháp phổ khối lượng, người ta xác định được trong tự nhiên chlorine có hai đồng vị là và có tỉ lệ phần trăm số nguyên tử tương ứng là 75,77% và 24,23%. Nguyên tử khối trung bình của chlorine là