Lý thuyết Hóa học 10 Kết nối tri thức Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
Haylamdo sưu tầm và biên soạn lý thuyết Hóa học lớp 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Hóa học 10 Kết nối tri thức Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
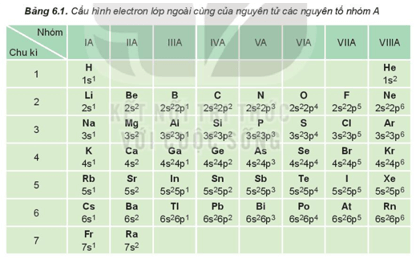
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
- Nhóm A gồm các nguyên tố s và p.
- Nguyên tử của các nguyên tố cùng một nhóm A có số electron lớp ngoài cùng (electron hóa trị) bằng nhau (trừ He trong nhóm VIIIA). Sự giống nhau về số electron hóa trị dẫn đến sự tương tự nhau về tính chất hóa học của các nguyên tố trong cùng nhóm A.
- Sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại một cách tuần hoàn. Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
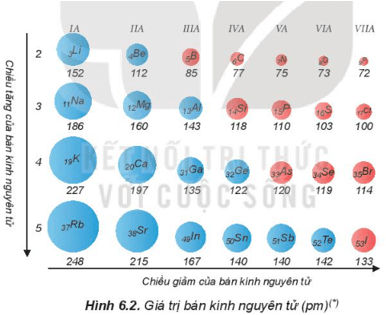
II. Bán kính nguyên tử
- Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại bán kính tăng là do lực hút giảm.
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
+ Trong một nhóm, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
Chú ý:
- Năng lượng ion hóa thứ nhất của nguyên tử là năng lượng tối thiểu cần thiết để tách electron thứ nhất ra khỏi nguyên tử ở thể khí, ở trạng thái cơ bản:
X (g) → X+ (g) + e
- Năng lượng ion hóa thứ nhất kí hiệu là I1, đơn vị KJ/ mol.
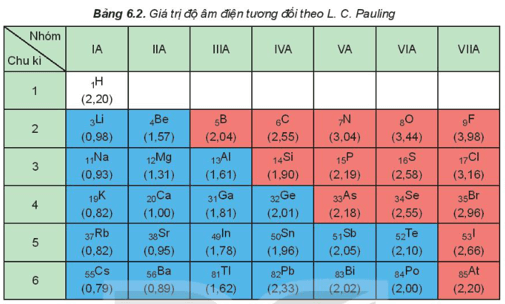
III. Độ âm điện
- Độ âm điện của một nguyên tử (χ) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
- Khi tham gia liên kết hóa học, nguyên tử có độ âm điện nhỏ dễ nhường electron; nguyên tử có độ âm điện lớn dễ nhận electron.
- Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
IV. Tính kim loại, tính phi kim
1. Khái niệm
- Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion dương.
Ví dụ: Na → Na+ + 1e
Nguyên tử càng dễ nhường electron tính kim loại càng mạnh.
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm.
Ví dụ: F + 1e → F-
Nguyên tử càng dễ nhận electron tính phi kim càng mạnh.
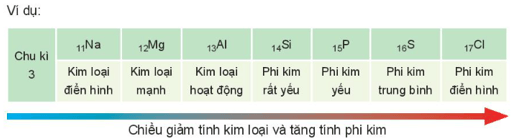
2. Sự biến đổi tính kim loại, tính phi kim
- Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với electron lớp ngoài cùng tăng. Do đó, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.