Lý thuyết Hóa học 10 Kết nối tri thức Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Haylamdo sưu tầm và biên soạn lý thuyết Hóa học lớp 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Hóa học 10 Kết nối tri thức Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
I. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
- Khi các phản ứng hóa học xảy ra thường có sự trao đổi nhiệt với môi trường làm thay đổi nhiệt độ môi trường.
+ Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Ví dụ: Phản ứng đốt cháy nhiên liệu, phản ứng tạo gỉ sắt, phản ứng oxi hóa glucose trong cơ thể, … đều là các phản ứng tỏa nhiệt.
+ Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Ví dụ: Các phản ứng trong lò nung vôi, nung clinker xi măng, … là các phản ứng thu nhiệt.
- Chú ý: Sự đốt cháy các loại nhiên liệu như xăng, dầu, cồn, khí gas, … xảy ra nhanh, tỏa nhiều nhiệt, dễ gây hỏa hoạn, thậm chí gây nổ mạnh, rất khó kiểm soát. Vì vậy, khi sử dụng chúng cần tuân thủ nghiêm ngặt các nguyên tắc phòng cháy.
II. Biến thiên enthalpy của phản ứng
1. Biến thiên enthalpy
- Biến thiên enthalpy của phản ứng (nhiệt phản ứng), kí hiệu là ∆rH là nhiệt lượng tỏa ra hay thu vào của phản ứng ở một điều kiện xác định.
- Phương trình hóa học kèm theo trạng thái của các chất và giá trị ∆rH gọi là phương trình nhiệt hóa học.
- Ví dụ: Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol CH4, sản phẩm là CO2(g) và H2O(l), thì sẽ giải phóng một nhiệt lượng là 890 kJ.
Như vậy phản ứng có biến thiên enthalpy r = –890 kJ và được biểu diễn bằng phương trình nhiệt hóa học như sau:
CH4(g) + 2O2(g) CO2(g) + 2H2O(l) r = –890 kJ
2. Biến thiên enthalpy chuẩn
- Biến thiên enthalpy chuẩn của một phản ứng hóa học, kí hiệu là r, chính là lượng nhiệt (tỏa ra hoặc thu vào) của phản ứng đó ở điều kiện chuẩn.
- Chú ý: Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K (25oC).
3. Ý nghĩa của biến thiên enthalpy
- Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt:
∆rH > 0: phản ứng thu nhiệt.
∆rH < 0: phản ứng tỏa nhiệt.
- Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều.
- Ví dụ: Cho phản ứng đốt cháy methane và acetylene:
(1) CH4(g) + 2O2(g) CO2(g) + 2H2O(l) r = -890 kJ
(2) C2H2(g) + O2(g) 2CO2(g) + H2O(l) r = -1300,2 kJ
Khi đốt cháy cùng một thể tích khí CH4 và C2H2, lượng nhiệt do C2H2 sinh ra nhiều gấp khoảng 1,5 lần lượng nhiệt do CH4 sinh ra.
III. Tính biến thiên enthapyl của phản ứng theo nhiệt tạo thành
1. Khái niệm nhiệt tạo thành
- Nhiệt tạo thành của một chất (∆fH) là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định.
- Nhiệt tạo thành chuẩn ( ) là nhiệt tạo thành ở điều kiện chuẩn.
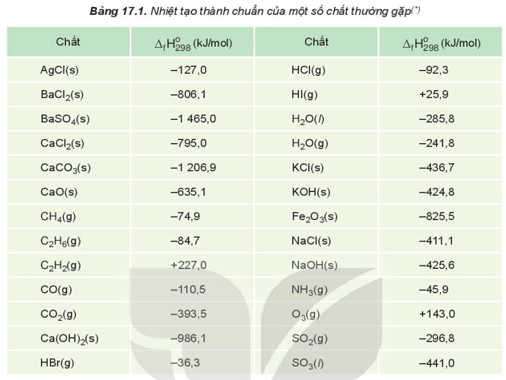
- Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0, ví dụ:
2. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
- Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ).
- Ở điều kiện chuẩn:
Trong tính toán cần lưu ý đến hệ số của các chất trong phương trình hóa học.
- Ví dụ: Hãy xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane:
C2H6(g) + >O2(g) 2CO2(g) + 3H2O (l)
Biết: Nhiệt tạo thành chuẩn của C2H6; O2; CO2; H2O lần lượt là -84,7 kJ/mol; 0 kJ/mol; -393,5 kJ/mol; -285,8 kJ/mol.
Hướng dẫn:
Tổng nhiệt tạo thành các chất đầu là:
= (-84,7.1) + 0.= - 84,7 (kJ)
Tổng nhiệt tạo thành các chất sản phẩm là:
= (-393,5.2) + (-285,8.3) = - 1644,4 (kJ)
⇒ Biến thiên enthalpy của phản ứng:
= - 1559,7 (kJ)
IV. Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết
- Phản ứng hóa học là quá trình phá vỡ các liên kết trong chất đầu và hình thành các liên kết mới để tạo thành sản phẩm.
- Biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí), bằng hiệu số giữa tổng năng lượng liên kết của các chất đầu và tổng năng lượng liên kết của các sản phẩm (ở cùng điều kiện nhiệt độ và áp suất).
- Ở điều kiện chuẩn:
- Ví dụ: Cho biết năng lượng liên kết trong các phân tử O2, N2, và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng:
N2(g) + O2(g) → 2NO(g)
Hướng dẫn:
= [945.1 + 494.1] – 607.2 = 225 (kJ)
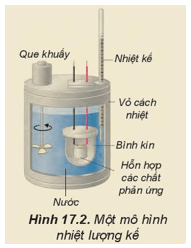
Chú ý: Biến thiên enthalpy của phản ứng có thể được xác định bằng nhiệt lượng kế.