Al + 6HNO3(đặc, nóng) → Al(NO3)3 + 3NO2 + 3H2O - Cân bằng phương trình hoá học
Phản ứng hoá học:
Al + 6HNO3(đặc, nóng) → Al(NO3)3 + 3NO2 + 3H2O
Điều kiện phản ứng
- Điều kiện nhiệt độ cao.
Cách thực hiện phản ứng
- Cho Al phản ứng với dung dịch axit HNO3 đặc, nóng tạo muối nhôm sunfat và có khí màu nâu bay ra.
Hiện tượng nhận biết phản ứng
- Phản ứng hoà tan chất rắn nhôm Al và sủi bọt khí khí màu nâu.
Bạn có biết
- Hầu hết các kim loại (trừ Pt, Au) đều phản ứng với axit HNO3 đặc, nóng.
- 3 kim loại Al, Cr, Fe bị thụ động hóa trong axit HNO3 đặc, nguội.

Ví dụ minh họa
Ví dụ 1:Cân bằng phản ứng hóa học sau:
Al + HNO3(đặc, nóng) → Al(NO3)3 + NO2 + H2O
Cho biết tổng hệ số cân bằng của các chất phản ứng là bao nhiêu?
A.5. B. 6. C. 7. D. 8.
Hướng dẫn giải
Chọn C.
Al + 6HNO3(đặc, nóng) → Al(NO3)3 + 3NO2↑ + 3H2O
Ví dụ 2:Hiện tượng xảy ra khi cho Al hòa tan trong dung dịch axit HNO3(đặc) là gì?
A. Al tan và sinh khí không màu.
B. Al tan và sinh khí hóa nâu trong không khí.
C. Al tan và sinh khí màu nâu trong không khí.
D. Không có hiện tượng xảy ra.
Hướng dẫn giải
Chọn C.
Al + HNO3(đặc, nóng) → Al(NO3)3 + NO2↑ + H2O
Khí NO2 màu nâu đỏ.
Ví dụ 3:Cho m gam Al tác dụng với dung dịch HNO3 đặc dư, sinh 6,72 lít khí màu nâu đỏ. Hỏi khối lượng Al đã tác dụng?
A. 2,7 gam.
B. 5,4 gam.
C. 7,2 gam.
D. 4,5 gam.
Hướng dẫn giải
Chọn A.
Al + 6HNO3(đặc, nóng) = Al(NO3)3 + 3NO2↑ + 3H2O
nNO2=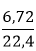
Theo phương trình phản ứng, ta có: nAl=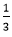
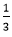
Vậy mAl=0,1.27=2,7 gam

