2CH4 → C2H2 + 3H2 - Cân bằng phương trình hoá học
Phản ứng hoá học:
2CH4 → C2H2 + 3H2
Điều kiện phản ứng
- Nhiệt độ: 1500°C
- Làm lạnh nhanh
Cách thực hiện phản ứng
- Phân hủy khí metan (CH4) ở nhiệt độ cao sau đó làm lạnh nhanh để tạo ra khí axetilen (C2H2) và khí hidro (H2)
Hiện tượng nhận biết phản ứng
- Khi phân hủy khí metan (CH4) ở nhiệt độ cao sau đó làm lạnh nhanh thì thấy có khí không màu thoát ra
Bạn có biết
- Phản ứng trên được gọi là phản ứng phân hủy
- Sản phẩm của phản ứng làm mất màu dung dịch brom
- Phản ứng trên là phản ứng điều chế axetilen phổ biết nhất

Ví dụ minh họa
Ví dụ 1: Poli (vinyl clorua) (PVC) được điều chế từ khí thiên nhiên (chứa 95% thể tích khí metan) theo sơ đồ chuyển hóa và hiệu suất mỗi giai đoạn như sau:
Metan (H = 15%) → Axetilen (H = 95%) → Vinylclorua (H = 90%) → PVC
Muốn tổng hợp 3,125 tấn PVC thì cần bao nhiêu m3 khí thiên nhiên (đo ở đktc)? (H = 1, C = 12, O = 16, Cl = 35,5)
A. 17466 m3
B. 18385 m3
C. 2358 m3
D. 5580 m3
Hướng dẫn:
Ta có sơ đồ phản ứng sau:
2nCH4 (H = 15%) → nC2H2 (H = 95%) → nCH2CHCl (H = 90%) → (CH2-CHCl)n

Đáp án B
Ví dụ 2: Cho 224,00 lít metan (đktc) qua hồ quang được V lít hỗn hợp A (đktc) chứa 12% C2H2; 10% CH4; 78% H2 (về thể tích). Giả sử chỉ xảy ra 2 phản ứng:
2CH4 → C2H2 + 3H2 (1)
CH4 → C + 2H2 (2)
Giá trị của V là:
A. 407,27
B. 448,00
C. 520,18
D. 472,64
Hướng dẫn
nCH4 = 10 mol
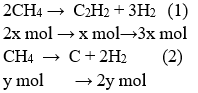
Sau phản ứng ta được:
nC2H2 = x (mol); nCH4 = 10 - (2x + y) (mol) và nH2 = 3x + 2y (mol)
Ta có các phương trình sau :
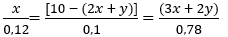
Giải ra ta được:
x = 24/11; y = 42/11
Tổng số mol của các khí trong A là:
x + 10 - (2x + y) + 3x + 2y = 2x + y + 10 = 2. 24/11 + 42/11 + 10 = 18,1818 mol
Vậy VA = 18,1818.22,4 = 407,2727 lít
Đáp án A
Ví dụ 3: Cho phản ứng sau: 2CH4 → C2H2 + 3H2 . Điều kiện để phản ứng xảy ra là :
A. Làm lạnh nhanh
B. Xúc tác
C. Nhiệt độ 1500°C
D. Cả A và C đều đúng
Đáp án D

