KOH + HNO3 → KNO3 + H2O - Cân bằng phương trình hoá học
Phản ứng hoá học:
KOH + HNO3 → KNO3 + H2O
Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
Cách thực hiện phản ứng
- Nhỏ từ từ HNO3 vào dung dịch KOH có chứa một mẩu quỳ tím.
Hiện tượng nhận biết phản ứng
- Ban đầu mẩu quỳ tím có màu xanh, sau khi nhỏ từ từ HNO3 mẩu quỳ mất màu, dư HNO3 quỳ chuyển sang màu đỏ.
Bạn có biết
- Phản ứng giữa KOH và HNO3 là phản ứng trung hòa.

Ví dụ minh họa
Ví dụ 1:
Cho 0,1 mol KOH phản ứng vừa đủ với 100ml HNO3 aM. Giá trị của a là
A. 0,1. B. 0,01. C. 0,05. D. 1.
Hướng dẫn giải
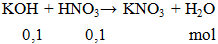
a = 0,1 : 0,1 = 1M.
Đáp án D.
Ví dụ 2:
Phản ứng nào sau đây là phản ứng trung hòa?
A. 2KOH + CO2 → K2CO3 + H2O
B. KOH + SO2 → KHSO3
C. KOH + HNO3 → KNO3 + H2O
D. 2KOH + CuSO4 → K2SO4 + Cu(OH)2
Hướng dẫn giải
Phản ứng trung hòa là phản ứng KOH + HNO3 → KNO3 + H2O
Đáp án C.
Ví dụ 3:
Cho 100ml HNO3 0,1M phản ứng vừa đủ với dung dịch KOH thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
A. 0,745g. B. 1,01g. C. 0,754g. D. 1,10g.
Hướng dẫn giải
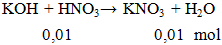
mmuối = 0,01.101 = 1,01 gam.
Đáp án B.

