Mn + H2SO4(loãng) → MnSO4 + H2 - Cân bằng phương trình hoá học
Phản ứng hoá học:
Mn + H2SO4(loãng) → MnSO4 + H2
Điều kiện phản ứng
Không điều kiện
Cách thực hiện phản ứng
Cho mangan tác dụng với dung dịch H2SO4(loãng)
Hiện tượng nhận biết phản ứng
Có khí không màu thoát ra
Bạn có biết
Mangan dễ tham gia phản ứng với các dung dịch axit không có tính oxi hóa tạo muối và khí hidro thoát ra.

Ví dụ minh họa
Ví dụ 1: Hòa tan 54,15g hỗn hợp 3 kim loại Mn, Fe, Cu vào dung dịch H2SO4 loãng thu được 8,96 lít khí H2, 32g chất rắn Y, và dung dịch Z . Lọc bỏ chất rắn Y, cô cạn cẩn thận dung dịch Z thu được khối lượng muối là :
A. 60,55g B. 60g
C. 45,5g D. 50,5g
Hướng dẫn giải:
Đáp án A
Đặt x = nMn mol ; y = nFe mol
Ta có mMn + mFe = 54,15 – 32 = 22,15 g ; nH2 = 8,96/22,4 = 0,4 mol
Mn + H2SO4(loãng) → MnSO4 + H2
x mol → x x mol
Fe + H2SO4(loãng) → FeSO4 + H2
y mol → y y mol
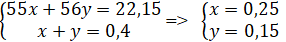
⇒ mZ = 0,25.151 + 0,15.152 = 60,55g
Ví dụ 2: Cấu hình e nào dưới đây đúng với Mn
A. [Ar] 4s23d5 B. [Ar] 4s13d6
C. [Ar] 4s23d4 D. [Ar]3d7
Hướng dẫn giải:
Đáp án A
Ví dụ 3: Hòa tan hoàn toàn 16,5 g mangan vào dung dịch H2SO4 loãng dư thì thu được V lít H2 đktc. Giá trị của V là :
A. 3,36 l B. 4,48 l
C. 6,72 l D. 2,24l
Hướng dẫn giải:
Đáp án C
Phương trình hóa học: Mn + H2SO4 (loãng) → MnSO4 + H2
Ta có nMn = 16,5/55 = 0,3 mol
Theo phương trình: nH2 = nMn = 0,3 mol ⇒ VH2 = 0,3.22,4 = 6,72

