2NaHSO3 + H2SO4 → Na2SO4 + 2SO2 ↑ + 2H2O - Cân bằng phương trình hoá học
Phản ứng hoá học:
2NaHSO3 + H2SO4 → Na2SO4 + 2SO2 ↑ + 2H2O
Điều kiện phản ứng
- điều kiện thường,
Cách thực hiện phản ứng
- Nhỏ H2SO4 vào ôngs nghiệm chứa NaHSO3.
Hiện tượng nhận biết phản ứng
- Có khí không màu, mùi hắc thoát ra.
Bạn có biết
- NaHSO3 phản ứng với các axit như HNO3, HCl… đều giải phóng khí.

Ví dụ minh họa
Ví dụ 1:
Nhỏ H2SO4 vào ống nghiệm chứa NaHSO3 thu được hiện tượng là
A. Có khí không màu, mùi hắc thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Không có hiện tượng gì.
Hướng dẫn giải
2NaHSO3 + H2SO4 → Na2SO4 + 2SO2 ↑ + 2H2O
SO2: khí không màu, mùi hắc.
Đáp án A.
Ví dụ 2:
Thể tích khí ở dktc thoát ra khi cho 10,4g NaHSO3 phản ứng hoàn toàn với lượng dư H2SO4 là (bỏ qua sự hòa tan của SO2 vào nước)
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
Hướng dẫn giải
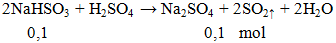
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Ví dụ 3:
Cho 1,04g NaHSO3 phản ứng hoàn toàn với lượng H2SO4, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 0,71 gam. B, 0,74 gam. C. 0,47 gam. D. 0,87 gam.
Hướng dẫn giải
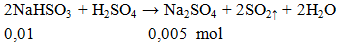
khối lượng muối = 0,005.142= 0,71gam.
Đáp án A.

