Đề thi Giữa kì 1 Hóa học lớp 9 năm 2023 có đáp án (4 đề)
Đề thi Giữa kì 1 Hóa học lớp 9 năm 2023 có đáp án (4 đề)
Haylamdo biên soạn và sưu tầm Đề thi Giữa kì 1 Hóa học lớp 9 năm 2023 có đáp án (4 đề) được tổng hợp chọn lọc từ đề thi môn Hoá học 9 của các trường trên cả nước sẽ giúp học sinh có kế hoạch ôn luyện từ đó đạt điểm cao trong các bài thi Hoá học lớp 9.

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2023
Môn: Hóa học lớp 9
Thời gian làm bài: 90 phút
(Đề số 1)
Câu 1 : Cho các chất sau: H2O, CO2, CaO và HCl. Số cặp chất phản ứng được với nhau là
A. 4
B. 5
C. 6
D. 3
Câu 2 : Hòa tan hoàn toàn 2,4 gam một oxit của kim loại hóa trị II cần vừa đủ 10 gam dung dịch HCl 21,9%. Xác định công thức hóa học của oxit trên.
A. FeO
B. CaO
C. MgO
D. CuO
Câu 3 : Dẫn hỗn hợp khí gồm CO2, CO, SO2 qua dung dịch nước vôi trong, dư. Khí thoát ra là
A. CO
B. CO2
C. SO2
D. CO2 và SO2
Câu 4 : Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg
B. Zn, Fe, Cu
C. Zn, Mg, Al.
D. Fe, Zn, Ag
Câu 5 : Dãy các dung dịch nào dưới đây làm đổi màu quỳ tím thành màu xanh?
A. NaOH, Ca(OH)2, MgSO4, NaCl
B. Ca(OH)2, HCl, NaOH, Ba(OH)2
C. FeCl2, H2O, NaOH, Ba(OH)2
D. Ba(OH)2, Ca(OH)2, NaOH, KOH
Câu 6 : Khi cho từ từ dung dịch NaOH cho đến dư vào ống nghiệm đựng dung dịch hỗn hợp gồm HCl và một ít phenolphtalein. Hiện tượng quan sát được trong ống nghiệm là:
A. Màu đỏ mất dần.
B. Không có sự thay đổi màu
C. Màu đỏ từ từ xuất hiện.
D. Màu xanh từ từ xuất hiện.
Câu 7 : Cho một khối lượng bột sắt dư vào 200 ml dung dịch HCl. Phản ứng xong thu được 2,24 lít khí (đktc). Nồng độ mol của dung dịch HCl đã dùng là
A. 1M
B. 0,1M
C. 2M
D. 0,2M
Câu 8 : Để phân biệt 2 dung dịch HCl và H2SO4 loãng. Ta dùng một kim loại là
A. Mg
B. Ba
C. Cu
D. Zn
Câu 9 : Cho sơ đồ chuyển hóa sau: X → Y → Z 
X, Y, Z có thể là
A. Na, Na2O, NaOH
B. P2O5, H3PO4, Ca3(PO4)2
C. Ba, BaSO4, BaO
D. CO2, Na2CO3, BaCO3
Câu 10 : Cho 6,4 gam Cu tác dụng với dung dịch H2SO4 đặc, nóng dư. Thu được V lít khí SO2 (đktc). Giá trị của V là
A. 2,24
B. 4,48
C. 3,36
D. 6,72
Câu 11 : Công thức hóa học của vôi sống là
A. Na3O
B. CaCO3
C. CaO
D. Ca(OH)2
Câu 12 : Cặp chất nào dưới đây tổn tại trong cùng một dung dịch
A. HCl và NaOH
B. KCl và HCl
C. Ba(OH)2 và H2SO4
D. KOH và H2SO4
Câu 13 : Dung dịch KOH phản ứng với dãy oxit:
A. CO2; SO2; P2O5; Fe2O3
B. Fe2O3; SO2; SO3; MgO
C. P2O5; CO2; Al2O3; SO3
D. P2O5; CO2; CuO; SO3
Câu 14 : Để nhận biết dung dịch NaOH và dung dịch Ba(OH)2 ta dùng thuốc thử là
A. phenolphtalein
B. quỳ tím
C. dung dịch H2SO4
D. dung dịch HCl
Câu 15 : NaOH có tính chất vật lý nào sau đây?
A. Natri hiđroxit là chất rắn không màu, ít tan trong nước
B. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt
C. Natri hiđroxit là chất rắn không màu, không tan trong nước.
D. Natri hiđroxit là chất rắn không màu, khi tan trong nước thu nhiệt.
Câu 16 : Dãy các bazơ bị phân hủy ở nhiệt độ cao là
A. Mg(OH)2, NaOH, Ca(OH)2, KOH
B. Cu(OH)2, Fe(OH)2, Ca(OH)2, Mg(OH)2
C. Cu(OH)2, Fe(OH)2, Fe(OH)3, Al(OH)3
D. Zn(OH)2, Ca(OH)2, KOH, NaOH
Câu 17 : Cho phương trình phản ứng:Na2CO3+ 2HCl → 2NaCl + X + H2O. X là chất nào sau đây?
A. CO
B. CO2
C. H2
D. Cl2
Câu 18 : Trường hợp nào sau đây có phản ứng tạo sản phẩm là chất kết tủa màu xanh?
A. Cho Cu vào dung dịch AgNO3
B. Cho Zn vào dung dịch AgNO3.
C. Cho dung dịch KOH vào dung dịch FeCl3.
D. Cho dung dịch NaOH vào dung dịch CuSO4.
Câu 19 : Ứng dụng nào dưới đây không phải là ứng dụng của NaCl
A. Chế tạo thuốc nổ đen
B. Gia vị và bảo quản thực phẩm
C. Làm nguyên liệu sản xuất NaOH
D. Làm nguyên liệu cơ bản cho nhiều ngành công nghiệp hóa chất.
Câu 20 : X là một chất rắn ở dạng bột, có các tính chất: không tan trong nước; tác dụng được với dung dịch HCl; bị nhiệt phân hủy. X là
A. NaCl
B. CaCO3
C. BaSO4
D. Ca(HCO3)2
Câu 21 : . Để phân biệt 2 loại phân bón hoá học là: NH4NO3 và NH4Cl. Ta dùng dung dịch:
A. KOH
B. Ca(OH)2
C. AgNO3
D. BaCl2
Câu 22 : Phần trăm về khối lượng của nguyên tố N trong phân ure là
A. 32,33%
B. 31,81%
C. 46,67%
D. 63,64%
Câu 23 : Nguyên tố có tác dụng kích thích cây trồng ra hoa, làm hạt là
A. Magie
B. Kali
C. Nitơ
D. Lưu huỳnh
Câu 24 : Oxit khi tan trong nước làm giấy quỳ chuyển thành màu đỏ là
A. MgO
B. P2O5
C. K2
D. CaO
Câu 25 : Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ca(OH)2 dư. Khối lượng chất kết tủa thu được là :
A. 10,0 g
B. 19,7 g
C. 5,0 g
D. 20 g
Đáp án và Hướng dẫn làm bài
| 1. A | 2. D | 3. A | 4. C | 5. D |
| 6. C | 7. A | 8. B | 9. D | 10. A |
| 11. C | 12. B | 13. C | 14. C | 15. B |
| 16. C | 17. B | 18. D | 19. A | 20. B |
| 21. C | 22. C | 23. B | 24. B | 25. A |
Câu 1 : A
Các cặp chất phản ứng được với nhau là: H2O và CO2; H2O và CaO; CO2 và CaO; CaO và HCl.
Câu 2 : D
Khối lượng axit có trong dung dịch là: mHCl = 10.21,9% = 2,19g
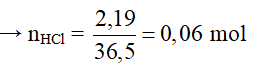
Đặt oxit là MO
MO + 2HCl → MCl2 + H2O
0,03 ← 0,06 mol
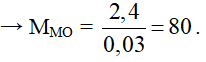
Vậy oxit là CuO.
Câu 3 : A
Khí CO không phản ứng với nước vôi trong.
Câu 4 : C
Các kim loại Zn, Mg, Al đứng trước (H) trong dãy hoạt động hóa học của kim loại nên tác dụng được với H2SO4 loãng.
Câu 5 : D
Các dung dịch bazơ Ba(OH)2, Ca(OH)2, NaOH, KOH … làm quỳ tím chuyển sang màu xanh.
Câu 6 : C
Trong dung dịch sau phản ứng có NaOH dư làm cho phenolphtalein chuyển sang màu đỏ.
Câu 7 : A
Fe + 2HCl → FeCl2 + H2
0,2 ← 0,1 mol
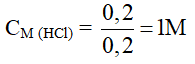
Câu 8 : B
Sử dụng kim loại Ba
+ Nếu có khí thoát ra → HCl
Ba + 2HCl → BaCl2 + H2 ↑
+ Nếu vừa có kết tủa trắng xuất hiện vừa có khí thoát ra → H2SO4
Ba + H2SO4 loãng → BaSO4 ↓ + H2 ↑
Câu 9 : D
CO2 + 2NaOH dư → Na2CO3 + H2O
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
BaCO3 
Câu 10 : A
Cu + 2H2SO4 đặc 
0,1 → 0,1 mol
V = 0,1.22,4 = 2,24 lít.
Câu 12 : B
HCl + NaOH → NaCl + H2O
KCl + HCl → không phản ứng
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
2KOH + H2SO4 → K2SO4 + 2H2O
Câu 13 : C
Dung dịch KOH có thể phản ứng được với nhiều oxit axit và oxit lưỡng tính.
Câu 14 : C
Sử dụng dung dịch H2SO4:
+ Có kết tủa trắng → Ba(OH)2
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
+ Không có hiện tượng xuất hiện → NaOH
2NaOH + H2SO4 → Na2SO4 + 2H2O
Câu 16 : C
Các bazơ không tan: Cu(OH)2, Fe(OH)2, Fe(OH)3, Al(OH)3 …. bị nhiệt phân hủy.
Câu 18 : D
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2 (↓ xanh)
Câu 20 : B
X không tan trong nước → loại A và D
X tác dụng với HCl → loại C
Câu 21 : C
Sử dụng AgNO3
+ Có kết tủa trắng → NH4Cl
NH4Cl + AgNO3 → AgCl (↓ trắng) + NH4NO3
+ Không có hiện tượng gì → NH4NO3
Câu 22 : C
Phân ure: CO(NH2)2
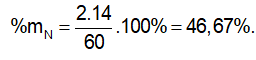
Câu 24 : B
P2O5 + 3H2O → 2H3PO4
H3PO4 là axit làm quỳ tím chuyển sang màu đỏ.
Câu 25 : A
Số mol CO2 = 2,24 : 22,4 = 0,1 mol
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
0,1 → 0,1 mol
Khối lượng kết tủa là: m = 0,1.100 = 10 gam.

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2023
Môn: Hóa học lớp 9
Thời gian làm bài: 90 phút
(Đề số 2)
Câu 1 : Dãy oxit nào dưới đây khi hòa tan trong nước thu được dung dịch axit?
A. BaO, SO2, CO2, SO3
B. P2O5, SO3, N2O5, CO2
C. CO, SO2, CuO, Cl2O7
D. NO, Al2O3, P2O5, SO2
Câu 2 : Cho dãy bazơ sau: KOH, NaOH, Mg(OH)2, Cu(OH)2, Fe(OH)3, Al(OH)3. Số chất trong dãy không bị nhiệt phân hủy là:
A. 3
B. 2
C. 4
D. 1
Câu 3 : Diêm tiêu có nhiều ứng dụng quan trong như: chế tạo thuốc nổ đen, làm phân bón, cung cấp nguyên tố nitơ và kali cho cây trồng,... Công thức hóa học của diêm tiêu là
A. KNO3
B. KClO3
C. NaNO3
D. NaNO2
Câu 4 : Loại phân đạm nào dưới đây có hàm lượng nitơ cao nhất?
A. Kali nitrat
B. Amoni sunfat
C. Ure
D. Amoni nitrat
Câu 5 : Dãy gồm các chất tác dụng được với dung dịch Na2CO3 là
A. H2SO4, NaOH và KNO3
B. HCl, KOH và SO2
C. H2SO4, Ca(OH)2 và MgCl2
D. NaOH, SO2 và KNO3
Câu 6 : Chỉ dùng dung dịch HCl có thể phân biệt được các dung dịch:
A. KOH, KHCO3, Na2CO3
B. KOH, NaOH, AgNO3
C. Na2SO4, Na2SO3, NaNO3
D. KOH, Na2CO3, AgNO3
Câu 7 : Khí N2 bị lẫn tạp chất là khí CO2, có thể dùng chất nào sau đây để thu được N2 tinh khiết?
A. H2SO4
B. Ca(OH)2
C. NaHSO3
D. CaCl2
Câu 8 : Trong các dãy oxit dưới đây, dãy nào thỏa mãn điều kiện tất cả các oxit đều phản ứng với axit clohiđric?
A. CuO, FeO, CO2
B. CuO, P2O5, FeO
C. CuO, SO2, BaO
D. CuO, BaO, Fe2O3
Câu 9 : Cho 1,82 gam hỗn hợp MgO và Al2O3 tác dụng vừa đủ với 250 ml dung dịch H2SO4 0,2M. Thành phần % khối lượng của mỗi oxit trong hỗn hợp là
A. 43,96% và 56,04%
B. 56,33% và 43,67%
C. 27,18% và 72,82%
D. 53,63% và 46,37%
Câu 10 : Oxit được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm là
A. CuO
B. ZnO
C. PbO
D. CaO
Câu 11 : Để nhận biết 3 khí không màu: CO2, O2, H2 đựng trong 3 lọ mất nhãn ta dùng
A. Giấy quỳ tím ẩm
B. Que đóm còn tàn đỏ, nước vôi trong
C. Than hồng trên que đóm
D. Dẫn các khí vào nước vôi trong
Câu 12 : Dẫn từ từ 4,48 lít khí CO2 (ở đktc) vào 2 lít dung dịch NaOH 0,1M, sau phản ứng thu được dung dịch
A. Na2CO3
B. Na2CO3 và NaHCO3
C. NaHCO3
D. Na2CO3 và NaOH dư
Câu 13 : Tính chất hóa học nào không phải là tính chất hóa học đặc trưng của axit
A. Tác dụng với kim loại
B. Tác dụng với muối
C. Tác dụng với oxit axit
D. Tác dụng với oxit bazơ
Câu 14 : Kim loại X tác dụng với H2SO4 loãng giải phóng khí hiđro. Dẫn toàn bộ lượng hiđro trên qua ống nghiệm chứa oxit, nung nóng thu được kim loại Y. Hai chất X, Y lần lượt là:
A. Ag và Zn
B. Cu và Ag
C. Na và Mg
D. Zn và Cu
Câu 15 : Cho một khối lượng bột kẽm dư vào 200 ml dung dịch HCl. Kết thúc phản ứng thu được 2,24 lít khí (đktc). Nồng độ mol của dung dịch HCl đã dùng là
A. 1M
B. 0,1M
C. 2M
D. 0,2M
Câu 16 : Dung dịch axit clohiđric tác dụng với sắt tạo thành:
A. Sắt (II) clorua và khí hiđro
B. Sắt (III) clorua và khí hiđro
C. Sắt (II) sunfua và khí hiđro
D. Sắt (II) clorua và nước
Câu 17 : Muốn pha loãng axit sunfuric đặc ta phải:
A. Rót nước vào axit đặc.
B. Rót từ từ nước vào axit đặc.
C. Rót nhanh axit đặc vào nước.
D. Rót từ từ axit đặc vào nước.
Câu 18 : Phản ứng giữa dung dịch Ba(OH)2 và dung dịch H2SO4 (vừa đủ) thuộc loại:
A. Phản ứng trung hoà
B. Phản ứng thế
C. Phản ứng hoá hợp
D. Phản ứng oxi hoá – khử.
Câu 19 : Dãy hóa chất nào dưới đây đều tác dụng được với dung dịch HCl?
A. Cu, K2O, Ba(OH)2, AgCl
B. Zn, FeO, Al(OH)3, CaCO3
C. H2O, BaO, KOH, Ag
D. CaO, NaCl, Al(OH)3, Mg
Câu 20 : Cặp chất nào sau đây cùng tồn tại trong một dung dịch (chúng không phản ứng với nhau)?
A. KOH và NaCl
B. KOH và HCl
C. KOH và CuCl2
D. KOH và Al(OH)3
Câu 21 : Nhóm các dung dịch có pH > 7 là
A. HCl, NaOH
B. H2SO4, HCl
C. KOH, Ca(OH)2
D. BaCl2, KNO3
Câu 22 : Công thức hóa học của đạm urê là
A. NH4NO3
B. NH4Cl
C. CO(NH2)2
D. (NH4)2SO4
Câu 23 : Cho 12,6 gam Na2SO3 tác dụng với H2SO4 dư. Thể tích SO2 thu được (đktc) là
A. 1,12 lít
B. 2,24 lít
C. 4,48 lít
D. 3,36 lít
Câu 24 : Cho hỗn hợp sau: NaCl, Na2CO3 và NaOH. Để thu được muối ăn tinh khiết, từ hỗn hợp trên có thể dùng một lượng dư dung dịch chất nào sau đây?
A. BaCl2
B. HCl
C. Na2CO3
D. CaCl2
Câu 25 : Biết 12 gam muối hỗn hợp muối gồm: CaCO3 và CaSO4 tác dụng vừa đủ với 400ml dung dịch HCl thu được 0,672 lít khí (ở đktc). Thành phần % theo khối lượng của CaCO3 và CaSO4 có trong hỗn hợp ban đầu lần lượt là:
A. 25% và 75%
B. 30% và 70%
C. 75% và 25%
D. 70% và 30%
Đáp án và Hướng dẫn làm bài
| 1. B | 2. B | 3. A | 4. C | 5. C |
| 6. D | 7. B | 8. D | 9. A | 10. D |
| 11. B | 12. C | 13. C | 14. D | 15. A |
| 16. A | 17. D | 18. A | 19. B | 20. A |
| 21. C | 22. C | 23. B | 24. B | 25. A |
Câu 1 : B
Nhiều oxit axit tác dụng với nước tạo thành dung dịch axit
Loại đáp án A do BaO là oxit bazơ
Loại đáp án C do CuO là oxit bazơ
Loại đáp án D do Al2O3 là oxit lưỡng tính.
Câu 2 : B
Các bazơ không tan bị nhiệt phân hủy
Vậy KOH, NaOH không bị nhiệt phân hủy.
Câu 4 : C
Phân ure có hàm lượng đạm cao nhất (46,67%).
Câu 5 : C
Na2CO3 + H2SO4 → Na2SO4 + CO2 ↑ + 2O
Na2CO3 + Ca(OH)2 → CaCO3 ↓ + 2NaOH
Na2CO3 + MgCl2 → MgCO3 ↓ + 2NaCl
Câu 6 : D
Sử dụng HCl
+ Có khí thoát ra → Na2CO3
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
+ Có kết tủa trắng xuất hiện → AgNO3
HCl + AgNO3 → AgCl ↓ + HNO3
+ Không có hiện tượng xuất hiện → KOH
KOH + HCl → KCl + H2O
Câu 7 : B
Sục hỗn hợp khí qua nước vôi trong dư, khí CO2 phản ứng bị giữ lại, khí N2 không phản ứng thoát ra thu được N2 tinh khiết.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Câu 8 : D
CuO, BaO, Fe2O3 là các oxit bazơ nên đều tác dụng với axit HCl.
Câu 9 : A
Gọi số mol MgO là a (mol); số mol Al2O3 là b (mol)
Khối lượng hỗn hợp là 1,82 gam → 40a + 102b = 1,82 (1)
Phương trình hóa học:
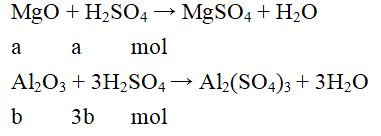
Ta có: naxit = a + 3b = 0,25.0,2 = 0,05 (2)
Từ (1) và (2) có a = 0,02 và b = 0,01
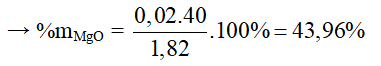
Câu 10 : D
CaO có tính hút ẩm mạnh nên được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm.
Câu 11 : B
- Sử dụng que đóm còn tàn đỏ cho vào các lọ chứa khí:
+ Que đóm bùng cháy: O2
+ Que đóm tắt: CO2; H2 (nhóm I)
- Nhận biết nhóm I: Dùng lượng dư nước vôi trong
+ Có kết tủa → CO2
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
+ Không hiện tượng → H2
Câu 12 : C
Ta có 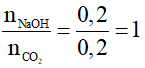
Câu 14 : D
Do X tác dụng với H2SO4 loãng, giải phóng H2 nên X không thể là Cu và Ag → loại A và B
Do H2 không khử được MgO để tạo thành Mg → loại C
Câu 15 : A
Zn + 2HCl → ZnCl2 + H2
0,2 ← 0,1 mol
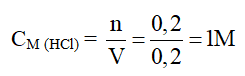
Câu 16 : A
Fe + 2HCl → FeCl2 + H2
FeCl2: sắt (II) clorua
Câu 19 : B
Loại A do Cu, AgCl không tác dụng với HCl
Loại C do H2O, Ag không tác dụng với HCl
Loại D do NaCl không tác dụng với HCl
Câu 20 : A
KOH + NaCl → không phản ứng
KOH + HCl → KCl + H2O
2KOH + CuCl2 → 2KCl + Cu(OH)2 ↓
KOH + Al(OH)3 → KAlO2 + 2H2O
Câu 21 : C
Các dung dịch KOH, Ba(OH)2 là các dung dịch bazơ nên có pH > 7.
Câu 23 : B
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
0,1 → 0,1 mol
→ Vkhí = 0,1.22,4 = 2,24 lít.
Câu 24 : B
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
HCl + NaOH → NaCl + H2O
Cô cạn cho H2O, HCl bay hơi được NaCl tinh khiết.
Câu 25 : A
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
0,03 → 0,03 mol
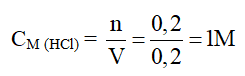
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2023
Môn: Hóa học lớp 9
Thời gian làm bài: 90 phút
(Đề số 3)
Phần I: Trắc nghiệm khách quan (3 điểm)
Câu 1 : CO2 không phản ứng với chất nào trong các chất sau?
A. dung dịch NaOH
B. dung dịch Ca(OH)2
C. CaO
D. dung dịch HCl
Câu 2 : Cặp chất nào sau đây có thể dùng để điều chế SO2 trong phòng thí nghiệm?
A. Al và H2SO4 loãng
B. NaOH và dung dịch HCl
C. Na2SO4 và dung dịch HCl
D. Na2SO3 và dung dịch HCl
Câu 3 : Cho 6,5 gam Zn vào dung dịch HCl dư đến khi kết thúc phản ứng thấy thu được V lít khí ở đktc. Giá trị của V là
A. 1,12 lít
B. 2,24 lít
C. 3,36 lít
D. 22,4 lít
Câu 4 : Cặp chất nào sau đây có thể dùng để điều chế khí H2 ?
A. Al và H2SO4 loãng
B. Al và H2SO4 đặc nóng
C. Cu và dung dịch HCl
D. Fe và dung dịch CuSO4
Câu 5 : Dãy oxit nào sau đây vừa tác dụng với nước, vừa tác dụng với dung dịch bazơ?
A. CaO, CuO
B. CO, Na2O
C. CO2, SO2
D. 2O5, MgO
Câu 6 : Chất nào sau đây được dùng để sản xuất vôi sống?
A. CaCO3
B. NaCl
C. K2CO3
D. Na2SO4
Câu 7 : Phản ứng giữa dung dịch HCl và NaOH là phản ứng
A. hóa hợp
B. trao đổi.
C. thế
D. phân hủy
Câu 8 : Cặp chất nào sau đây xảy ra phản ứng:
A. Na2O + NaOH
B. Cu + HCl
C. P2O5 + H2SO4 loãng
D. Cu + H2SO4 đặc, nóng
Câu 9 : Axit sunfuric loãng tác dụng được với dãy chất nào sau đây?
A. Zn, CO2, NaOH
B. Zn, Cu, CaO
C. Zn, H2O, SO3
D. Zn, NaOH, Na2O
Câu 10 : Trong tự nhiên muối natri clorua có nhiều trong:
A. Nước biển.
B. Nước mưa.
C. Nước sông.
D. Nước giếng.
Câu 11 : Điện phân dung dịch natri clorua (NaCl) bão hoà trong bình điện phân có màng ngăn ta thu được hỗn hợp khí là:
A. H2 và O2.
B. 2 và Cl2.
C. O2 và Cl2.
D. Cl2 và HCl
Câu 12 : Trong các loại phân bón sau, phân bón hoá học kép là:
A. (NH4)2SO4
B.Ca(H2PO4)2
C. NaCl
D.KNO3
Phần II: Tự luận (7 điểm)
Câu 1 (2 điểm ) : Hoàn thành sơ đồ phản ứng, ghi rõ điều kiện nếu có.
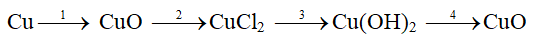
Câu 2 (3 điểm) : Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.
a) Viết các phương trình hóa học xảy ra.
b) Tính khối lượng mỗi chất có trong hỗn hợp ban đầu.
Câu 3 (2 điểm) : Phân biệt các dung dịch sau: NaOH; HCl; BaCl2; H2SO4 chứa trong các lọ riêng biệt, mất nhãn.
Đáp án và Hướng dẫn làm bài
Phần I: Trắc nghiệm
Câu 1 : D
Câu 2 : D
Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
Câu 3 : C
Zn + 2HCl → ZnCl2 + H2
0,1 → 0,1 mol
→ V = 0,1.22,4 = 2,24 lít.
Câu 4 : A
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2
Câu 5 : C
Các oxit axit như: CO2; SO2 … vừa tác dụng với nước, vừa tác dụng với dung dịch bazơ.
Câu 6 : A
CaCO3 
CaO: vôi sống
Câu 7 : B
Phản ứng xảy ra giữa dd axit với dd bazơ là phản ứng trao đổi.
Câu 8 : D
Cu + 2H2SO4 đặc 
Câu 9 : D
Zn + H2SO4 loãng → ZnSO4 + H2
2NaOH + H2SO4 → Na2SO4 + 2H2O
Na2O + H2SO4 → Na2SO4 + H2O
Câu 10 : A
Câu 11 : B
2NaCl + 2H2O 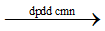
Câu 12 : D
Phần II: Tự luận
Câu 1 :
2Cu + O2 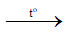
CuO + 2HCl → CuCl2 + H2O
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu(OH)2 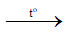
Câu 2 :
a) Mg + 2HCl → MgCl2 + 2 (1)
MgO + 2HCl → MgCl2 + H2O (2)
b)
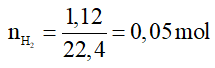
Theo PTHH (1) có nMg = nkhí = 0,05 mol
→ mMg = 0,05.24 = 1,2 gam; mMgO = 9,2 – 1,2 = 8 gam.
Câu 3 :
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím:
+ Quỳ tím hóa xanh: NaOH
+ Quỳ tím không đổi màu: BaCl2
+ Quỳ tím hóa đỏ: HCl; H2SO4 (nhóm I)
- Phân biệt nhóm I: Sử dụng BaCl2
+ Xuất hiện kết tủa trắng → H2SO4
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
+ Không hiện tượng: HCl

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2023
Môn: Hóa học lớp 9
Thời gian làm bài: 90 phút
(Đề số 4)
Phần I: Trắc nghiệm khách quan (3 điểm)
Câu 1 : Dãy chất nào dưới đây gồm các oxit tác dụng được với dung dịch HCl?
A. CaO, Na2O, SO2
B. FeO, CaO, MgO
C. CO2, CaO, ZnO
D. MgO, CaO, NO
Câu 2 : Dãy chất nào dưới đây gồm các oxit tác dụng được với nước?
A. CaO, CuO, SO3, Na2O.
B. CaO, N2O5, K2O, CuO.
C. Na2O, BaO, N2O, FeO.
D. SO3, CO2, BaO, CaO.
Câu 3 : Oxit bazơ nào sau đây được dùng để làm khô nhiều nhất?
A. CuO
B. FeO
C. CaO
D. ZnO
Câu 4 : Để làm sạch khí O2 có lẫn tạp chất là khí CO2 và khí SO2 có thể dùng chất nào dưới đây?
A. Ca(OH)2
B. CaCl2
C. NaHSO3
D. H2SO4
Câu 5 : Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng?
A. Ag, Fe, Mg
B. Fe, Cu, Al
C. Al, Mg, Zn
D. Zn, Cu, Mg
Câu 6 : Nhỏ từ từ dung dịch H2SO4 vào ống nghiệm đựng Cu(OH)2 thấy?
A. Cu(OH)2 không tan
B. Cu(OH)2 tan dần, dung dịch không màu.
C. Cu(OH)2 tan dần, dung dịch màu xanh lam và có khí bay ra
D. Cu(OH)2 tan dần, dung dịch có màu xanh lam.
Câu 7 : Chất nào dưới đây không tác dụng được với axit H2SO4 đặc, nguội
A. Cu
B. Al
C. Mg
D. Zn
Câu 8 : Dung dịch kiềm không có những tính chất hóa học nào sau đây?
A. Làm quì tím chuyển sang màu xanh
B. Tác dụng với axit
C. Tác dụng với dung dịch oxit axit
D. Bị nhiệt phân hủy tạo thành oxit bazơ
Câu 9 : Cặp chất có thể tồn tại được trong cùng một dung dịch là
A. NaCl và NaOH
B. KOH và H2SO4
C. Ca(OH)2 và HCl
D. NaOH và FeCl2
Câu 10 : Loại phân đạm có hàm lượng nitơ cao nhất là
A. (NH4)2SO4
B. NH4NO3
C. CO(NH2)2
D. NH4Cl
Câu 11 : Dãy gồm các phân bón hóa học đơn là
A. KCl, NH4Cl, (NH4)24 và Ca(H2PO4)2
B. KCl, KNO3, Ca3(PO4)2 và Ca(H2PO4)2
C. K24, 4NO3, (NH4)3PO4 và Ca(H2PO4)2
D. KNO3, KCl, NH4H24 và K2SO4.
Câu 12 : Cho các chất: SO2, NaOH, MgCO3, CaO và HCl. Số cặp chất phản ứng được với nhau là
A. 2
B. 4
C. 3
D. 5
Phần II: Tự luận (7 điểm)
Câu 1 (2 điểm) :
a/ Cho các chất sau: CaO, SO2, HCl, NaOH, P2O5, H2SO3, Na2O, Ca(OH)2.
Hãy cho biết chất nào thuộc oxit bazơ, oxit axit, bazơ, axit, muối?
b/ Hoàn thành sơ đồ phản ứng sau:
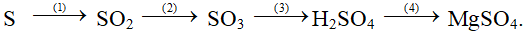
Câu 2 (2 điểm) : Trình bày phương pháp hóa học nhận biết các dung dịch đựng trong các lọ mất nhãn sau: HCl, NaOH, Na2SO4, NaCl.
Câu 3 (3 điểm) : Biết 8 (gam) CuO phản ứng vừa đủ với 200 gam dung dịch axit clohiđric.
a) Tính khối lượng muối có trong dung dịch thu được sau phản ứng.
b) Tính nồng độ phần trăm dung dịch axit cần dùng.
Đáp án và Hướng dẫn làm bài
Phần I: Trắc nghiệm
Câu 1 : B
Do FeO, CaO, MgO là các oxit bazơ.
Câu 2 : D
Loại A và B do CuO không tác dụng với nước.
Loại C do FeO không tác dụng với nước.
Câu 3 : C
CaO có tính hút ẩm mạnh nên được dùng để làm khô nhiều chất.
Câu 4 : A
Dẫn hỗn hợp khí qua dung dịch nước vôi trong (Ca(OH)2) dư. Khí CO2 và SO2 phản ứng bị giữ lại, khí O2 không phản ứng thoát ra khỏi dung dịch thu được O2 tinh khiết.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
Câu 5 : C
Các kim loại Al, Mg, Zn đứng trước H trong dãy hoạt động hóa học của kim loại nên tác dụng được với H2SO4 loãng.
Câu 6 : D
Cu(OH)2 (rắn) + H2SO4 (không màu) → CuSO4 + 2H2O
Hiện tượng: Cu(OH)2 tan dần, sau phản ứng thu được dung dịch có màu xanh lam.
Câu 7 : B
Câu 8 : D
Câu 9 : A
NaCl + NaOH → không phản ứng
2KOH + H2SO4 → K2SO4 + 2H2O
Ca(OH)2 + 2HCl → CaCl2 + 2O
2NaOH + FeCl2 → Fe(OH)2 ↓ + 2NaCl
Câu 10 : C
Ure CO(NH2)2 có hàm lượng nitơ cao nhất
Câu 11 : A
Loại B, D do có KNO3 là phân bón kép
Loại C do (NH4)3PO4 là phân bón kép.
Câu 12 : D
Các cặp chất xảy ra phản ứng hóa học là: SO2 và NaOH; SO2 và CaO; NaOH và HCl; MgCO3 và HCl; CaO và HCl.
Phần II: Tự luận
Câu 1 :
a)
Oxit bazơ: CaO; Na2O
Oxit axit: SO2; 2O5
Axit: HCl, H2SO3.
Bazơ: NaOH; Ca(OH)2.
b)
1) S + O2 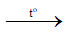
2) 2 + O2 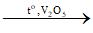
3) SO3 + H2O → H2SO4
4) Mg + H2SO4 (loãng) → MgSO4 + H2 ↑
Câu 2 :
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → HCl
+ Quỳ tím chuyển sang màu xanh → NaOH
+ Quỳ tím không đổi màu → Na2SO4, NaCl (nhóm I)
- Phân biệt nhóm I: Dùng BaCl2
+ Có kết tủa trắng → Na2SO4
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
+ Không hiện tượng → NaCl
Câu 3 :
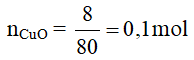
CuO + 2HCl → CuCl2 + H2O
a) Theo PTHH có: = 0,1 mol
Khối lượng muối có trong dung dịch sau phản ứng là:
mmuối = 0,1. 135 = 13,5 gam.
b) Theo PTHH có: nHCl = 2.nCuO = 0,2 mol
Khối lượng chất tan có trong 200 gam dung dịch axit clohiđric là:
mHCl = 0,2.36,5 = 7,3 gam
Nồng độ phần trăm của dung dịch HCl cần dùng là: